1. ZEMLJA I NJENO POREKLO
1.3. I reč, dve…
|
Pre nego što pređemo na detaljnije opise rađanja svemira i postanka naše planete Zemlje, za bolje razumevanje teksta potrebno je poznavanje nekoliko novih pojmova. Stoga ćemo ukratko dati opis nekoliko pojmova koji se sreću u tekstu: materija, energija, atom, antičestice, elementarne čestice, foton i prazan prostor. |
1.3.1. Materija
 Fotografisao Mladen Franko |
Oko nas se nalazi mnoštvo različitih stvari. Neke od njih dotičemo (na primer drvo, razne metale, knjigu, zemlju), neke udišemo (na primer vazduh), neke pijemo (na primer voda), a okruženi smo i ljudima, biljkama i životinjama. Ali, da li ste se ponekad zapitali od čega je sve što postoji u prirodi načinjeno? Sve stvari oko nas su napravljene od materije koja ima masu i zauzima određenu zapreminu. Moderna fizika kaže da se materija sastoji od različitih čestica, od kojih svaka ima masu i veličinu. Do sada je poznato da materija može postojati u različitim agregatnim stanjima: gasovitom, tečnom, čvrstom i plazmi. Glavna razlika ovim stanjima je u gustini čestica. Ali kako radoznalosti naučnika nema kraja, otkriveno je da materija osim u navedenim može da postoji i u drugim stanjima, kao što je npr, Boze-Ajnštajnov kondenzat. Njih ne srećemo svakodnevno. Neka od njih postoje samo u teoriji, neka se mogu reprodukovati samo u laboratorijama, dok su druga toliko nova da naučnici još uvek otkrivaju detalje. Nove teorije i otkrića nastaju sve vreme. |
|
Od čega je napravljena materija? Materija je napravljena od sićušnih, oku nevidljivih čestica, koje zovemo atomi. Ipak, ljudi su pronašli način da ih vidimo! |
|
 Spirit469/Wikimedia Common (CC BY-SA 3.0 DED) |
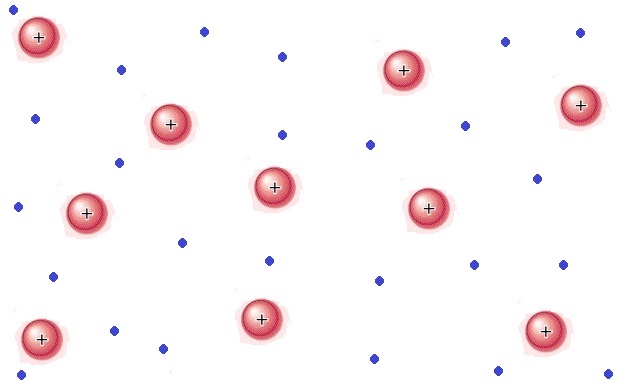
Šta je plazma? Plazma je jonizovan gas. Sastoji se od naelektrisanih čestica (jona i slobodnih elektrona). |
 Prilagođeno od DaisyDaisy/Wikimedia Commons (Public Domain) |
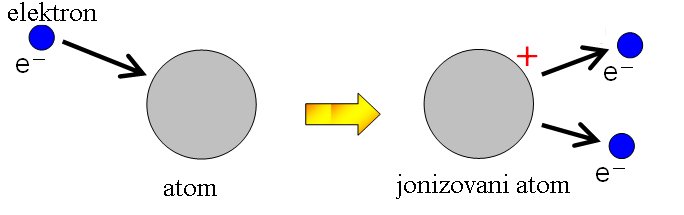
Šta je jonizacija? Jonizacija je proces u kome čestica velike energije predaje nekom od elektrona u omotaču atoma dovoljnu količinu energije da elektron napusti atom. Tada nastajui pozitivno naelektrisan atom (jon) i negativno naelektrisan elektron koji je napustio atom. |
|
 PxHhere (CC0)  Nasa, Esa/Wikimedia Commons (Public Domain) |
Gde možemo naći plazmu? Plazma nije uobičajeno stanje materije na Zemlji, ali ste je već nebrojeno puta videli. Kada upalite neonsku sijalicu ili ako koristite plazma displeje za televizijske i kompjuterske ekrane, vidite je. Ovo što vidite je delo ljudskih ruku. Plazma je najčešće stanje materije u svemiru: zvezda, gasne magline i međuzvezdanog prostora. Sama Zemlja je okružena plazmom i to zovemo jonosfera. Pojave kao što su munja i polarna svetlost predstavljaju materiju u stanju plazme. |
|
Saznajte više o plazmi: |
 NIST/JILA/CU-Boulder/Wikimedia Commons (Public Domain) |
Da li postoje i druga agregatna stanja osim: čvrstog, tečnog, gasovitog i plazme? Da postoje, ali se ona javljaju samo u ekstremnim situacijama. Takvo stanje je na primer Boze–Ajnštajnov (Bose–Einsteinov kondezat). |
|
Šta je Boze–Ajnštajnov kondenzat? Pretpostavljamo da vas reč kondenzat asocira na kondenzaciju — proces pri kojem se molekuli gasa sakupljaju i kondenzuju u tečnost. Pri tome molekuli gasa gube energiju, a njihovo kretanje se usporava. Na temperaturi apsolutne nule*, sva kretanja molekula prestaju. U blizini apsolutne nule čestice se kreću ekstremno sporo, te poprimaju kvantne osobine. Atomi gube svoje identitete i spajaju se kako bi formirali ono što se ponekad naziva „super atom.“ To je Boze-Ajnštajnov kondenzat. *Apsolutna nula: 273.15 0C (stepeni Celzijusa) ili 0 K (Kelvina) |
|
Ko je došao na ideju za ovaj kondenzat? Naučnici Satjendra Boze (Satyendra Bose) i Albert Ajnštajn (Albert Einstein), su 1920. godine predvideli ovo stanje materije Za realizaciju ovog stanja trebalo je imati odgovarajuću opremu kojom bi se mogla ostvariti temperatura bliska apsolutnoj nuli. |
|
Kada je realizovan Boze–Ajnštajnov kondezat? Boze–Ajnštajnov kondenzat je realizovan mnogo godina kasnije, tek 1995. godine, kada su se razvile posebne tehnike hlađenja (usporavanja) atoma zasnovane na laserskom hlađenju* i zarobljavanja atoma magnetnim klopkama**. To stanje su prvi realizovali naučnici Erik Kornel (Eric Cornell) i Karl Viman (Carl Wieman). Oni su uspeli da ohlade atome rubidijuma na 170 nK (170.10-9 K). *Kod laserskog hlađenja laserski zrak se rasejava na atomu. Rasejani zraci odvode više energije nego što laserski zrak dovodi. **Magnetna klopka je klopka bez zidova. Kada bi sud imao zidove u kome se gas hladi, atomi bi se zadržali na površini zidova. |
|
Boze-Ajnštajnov kondenzat: |
|
Plazma i Boze–Ajnštajnov kondenzat: |
 Fotografije: Bose-Einstein kondenzat (NIST/Wikimedia Commons, Public Domain), čvrsto telo i tečnost (fotografisao Mladen Franko), gas (R. Clucas/ Wikimedia Commons, Public Domain), plazma (Luc Viatour, CC BY-SA 3.0 DEED) |
1.3.2. Energija
 |
Kada neko spomene reč energija, na šta najčešće pomislite? Na energiju Sunca? Na električnu energiju ili možda na neki drugi oblik energije? |
Čuvena Ajnštajnova jednačina kojom je utvrđeno da je moguće pretvaranje materije u energiju i obrnuto.  Prilagođeno od Wikimedia Common (Public Domain) |
Šta je energija? Energija je sposobnost tela da izvrši rad. Energija može postojati u različitim oblicima kao što su: kinetička, potencijalna, svetlosna, toplotna, električna, hemijska, zvučna energija itd. Od kada postoji svemir postoji i energija. U svemiru ne postoje tela, a da ne poseduju energiju. Ona je svugde: u vašem telu, u vašoj kući, bašti, itd. Čak i kada spavate ili čitate knjigu, vaše telo jednu vrstu energije pretvara u drugu, da bi se vaše srce, protok krvi i vaši mišići pomerali. Bez energije ne mogu postojati ni druga živa bića. Ona je neophodna biljkama, mašinama — SVEMU i SVIMA. |
|
Energija ne može biti stvorena ili uništena, ali zato se može menjati iz jednog oblika u drugi. Primer: Ugalj se može sagoreti da se dobije električna energija. Prirodni gas i drvo, kada se sagore, daju toplotnu energiju. Kada vozite bicikl, vaši mišići hemijsku energiju transformišu u kinetičku, i to je ono što čini da se bicikl kreće. |
|
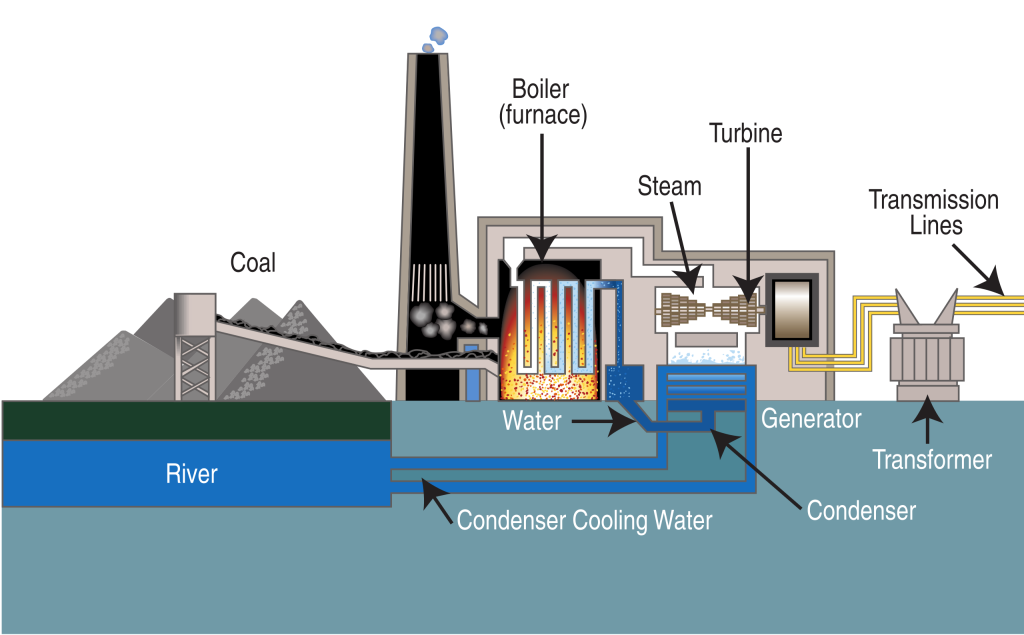 Tennessee Valley Authority/Wikimedia Commns (Public Domain) |
 Fotografisao Mladen Franko |
|
Saznajte još ponešto o energiji: |
1.3.3. Atomi i njihova struktura
 |
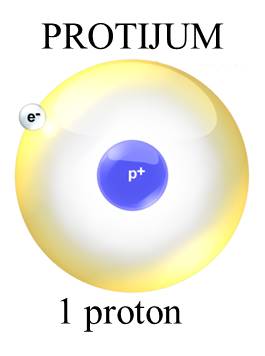
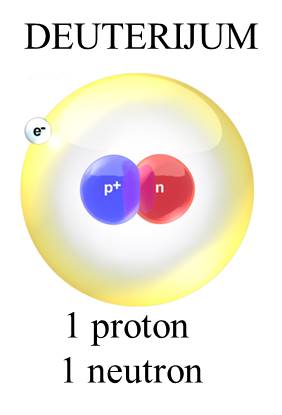
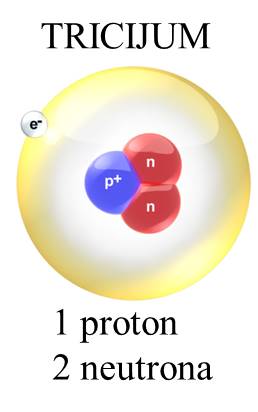
Atomi su najmanje jedinice materije koje definišu hemijske elemente. Od njih je izgrađeno sve što se nalazi oko nas, bilo to živa ili neživa materija. Atomi su izgrađeni od još manjih čestica — elektrona, protona i neutrona. Kad se atomi kombinuju sa drugim atomima, grade molekule. Elektroni su negativno naelektrisane čestice. Protoni su pozitivno naelektrisane čestice. Hemijski elementi su definisani brojem protona u atomskom jezgru. Neutroni su čestice koje nemaju naelektrisanje. Kakvo je naelektrisanje jezgra? Jezgro je pozitivno naelektrisano. Zašto? |
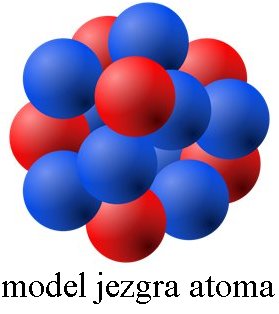
Marekich/Wikimedia Commons (CC BY-SA 3.0 DEED).
Prilagodeno od Richard Parsons/Wikipedia Commons (CC BY-SA 3.0 DEED). |
Gde se ove čestice nalaze u atomu? Centralno mesto atoma zauzima jezgro koje čine neutroni i protoni. Oko jezgra se nalazi oblak elektrona u kome se oni haotično kreću velikim brzinama poput brzina od 1000 000 m/s ili još više. U atomu: broj protona = broj elektrona. Ako je broj elektrona jednak broju protona u atomu, tada je atom elektroneutralan. |
|
 Fotografisao Mladen Franko |
 Furman/Wikimedia Commons (CC BY-SA 3.0 DEED) |
|
|
Ventilator ima lopatice. Kada je isključen, jasno ih vidite i znate gde se nalaze. Ako uključite ventilator da li možete videti lopatice i reći gde se one nalaze? Naravno da ne možetejer se lopatice ventilatora prebrzo kreću. Slično lopaticama ventilatora, samo mnogo, mnogo brže kreću se elektroni oko jezgra atoma. Stoga ne možemo tačno reći gde se nalaze. |
||
 |
Koja sila deluje između elektrona i protona u atomu? Između elektrona i jezgra vlada privlačna elektromagnetna sila — elektroni uvek imaju negativno naelektrisanje, a jezgro pozitivno naelektrisanje. Ova sila je jaka, a razlog za to je što je atom veoma mali. Rastojanje između jezgra i atoma je oko 10-10 m (0.0000000001 m) Zašto tada elektroni ne padnu na jezgro u atomu? Elektron je naelektrisana čestica, a svaka naelektrisana čestica koja se kreće ubrzano emituje elektromagnetno zračenje i time gubi energiju. Tokom vremena energija elektrona bi se smanjivala, dok bi putanja bila spirala ka jezgru. Na kraju bi elektron pao na jezgro. Ovako bi se elektron ponašao prema teorijama u klasičnoj mehanici. Međutim, to ne dešava, a elektron neprestano „kruži“ oko jezgra! (Za sada jednostavno objašnjenje, a kasnije će uslediti i malo složenije.) Zašto? U svetu atoma, odnosno u mikrosvetu, postoje drugačiji zakoni. Mikročestice, gde spada i elektron, ne povinuju se uvek zakonima makrosveta, već zakonima mikrosveta. U nauci se ovi zakoni opisuju kvantnom mehanikom. Znamo da elektron ipak ponekad napusti atom. Kako je to moguće? Samo ako se elektronu doda odgovarajući iznos spoljašnje energije, tada elektron može napustiti atom. Ta spoljašnja energija se naziva jonizovana energija. Kada elektron napusti atom, nastaje pozitivno naelektrisan jon. |
 |
Šta drži protone i neutrone na okupu u jezgru? Jaka nuklearna sila deluje među protonima i neutronima. Nešto više o njoj u poglavlju o fundamentalnim silama. |
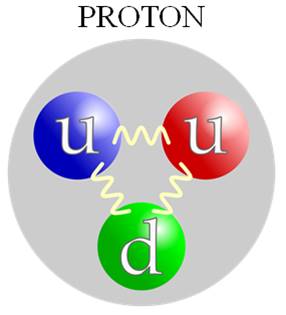
Prilagodeno od Harp/Wikimedia Commons (CC BY-SA 2.5 DEED) |
Da li elektroni, protoni i neutroni imaju strukturu? Elektron nema unutrašnju strukturu jer spada u elementarne čestice. Protoni i neutroni imaju unutrašnju strukturu, što znači da nisu elementarne čestice. Oni su sastavljeni od kvarkova. |
 Prilagođena fotografija fuldbalskog stadiona Crvena zvezda u Beogradu, Srbija, Vlada Marinković/Wikipedia Commons (CC BY-SA 3.0) Zamislite da atom ima veličinu tipičnog fudbalskog stadiona. U centru stadiona bilo bi jezgro veličine glave čiode, dok bi elektroni „trčali“ oko trbina. Sve ostalo je prazan prostor. |
Šta se nalazi između čestica atoma? U odnosu na atom, dimenzije jezgra su jako male. Hajde da se poigramo brojkama i da uporedimo dimenzije jezgra i atoma. Prosečan prečnik jezgra je oko Primer: Da je atom helijuma veličine Zemlje, elektroni bi bili u Zemljinoj atmosferi, a jezgro bi bilo veličine košarkaške lopte u centru Zemlje. Više o praznom prostoru u daljem tekstu. |
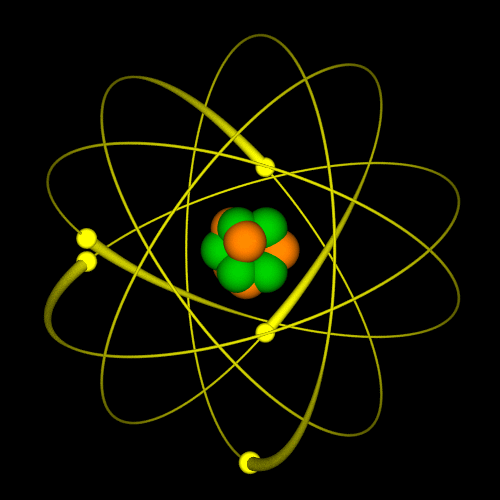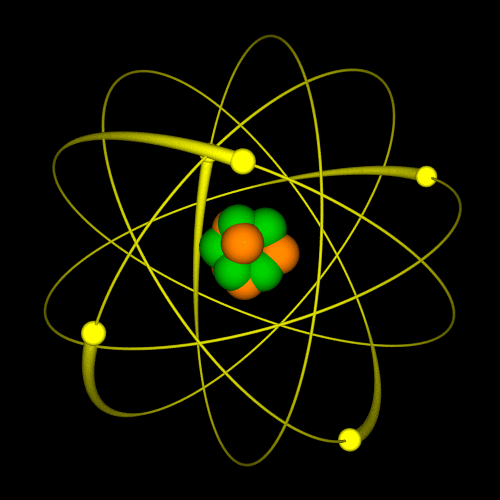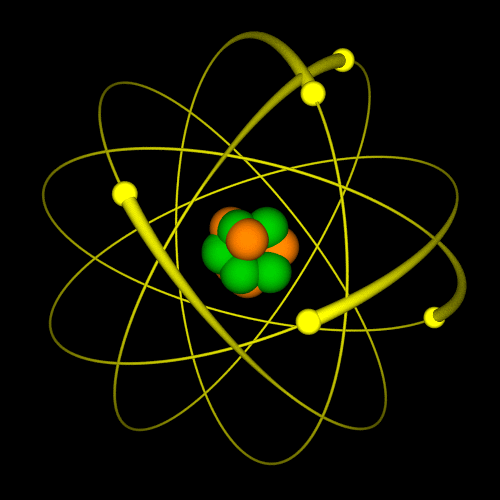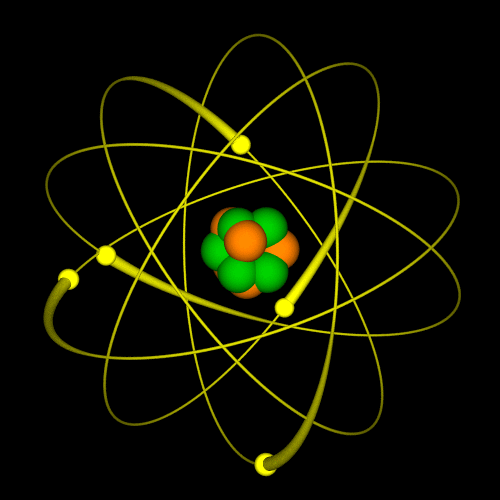 LG UltraLink/Wikimedia Common (CC BY-SA 4.0 DEED) 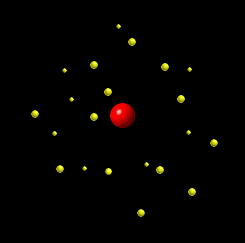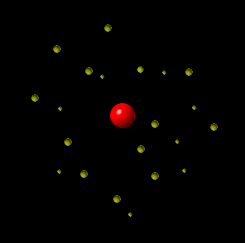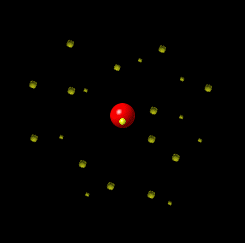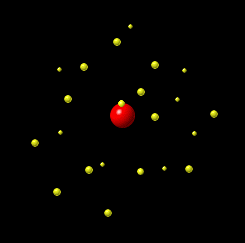 LG UltraLink/Wikimedia Common (CC BY-SA 4.0 DEED) |
Tokom dva veka naučnici su kreirali različite modele atoma. Sa novim saznanjima i predstava o atomu se menjala. Nekada se verovalo da se elektron ponaša slično planetama u solarnom sistemu: jezgro je Sunce, a orbite elektrona su planete. Sa novim saznanjima, pokazalo se da je ova najpopularnija slika atoma pogrešna. Prema savremenoj teoriji predstava o atomu, današnja je drugačija. Vizuelno se može zamisliti na sledeći način: u sredini je jedna mala kuglica i to je jezgro. Oko ove kuglice nalazi se oblak – elektronski oblak. |
|
Zbog čega ne možemo tačno odrediti položaj elektrona? Ako postoje planete koje se kreću po orbitama oko Sunca, tada možete predvideti, tačno gde će se kretati u budućnosti. Tako možete relativno tačno znati gde će biti planeta sledeće nedelje, meseca, godine ili za 100 godina. Kada govorimo o kretanju elektrona, stvar nije toliko laka. Umesto putanje elektrona imamo verovatnoću nalaženja. Da bi se nacrtala orbita elektrona, potrebno je egzaktno znati gde je elektron i u kom pravcu ide, te koliko brzo se kreće. Za opis pojava u svetu atoma i subatomskih čestica (čestica manjih od atoma) koristi se kvantna teorija. U kvantnoj mehanici postoji princip neodređenosti koga je formulisao nemački fizičar Verner Karl Hajzenberg (Werner Karl Heisenberg) 1927. godine. Prema ovom principu nemoguće je istovremeno ustanoviti brzinu i položaj elektrona u prostoru. Možemo pretpostaviti gde je elektron, ali ne i kolikom se brzinom kreće. Možemo pretpostaviti kolikom se brzinom kreće elektron, ali ne i gde se nalazi. Elektron može biti bilo gde oko jezgra ako znamo brzinu kretanja, ili može imati nepoznate brzine ako znamo gde je. |
|
Gledajući video saznajmo nešto više o strukturi atoma: |
|
Priča o atomu ne bi bila potpuna bez kvantno-mehaničkog modela: |
|
Ono o čemu su nekad naučnici maštali — da vide unutrašnjost atoma i njegovu strukturu — danas je moguće zahvaljujući novim instrumentima poput laserske kvantne kamere. Naučnici su uspeli, pomoću sofisticiranog mikroskopa, da snime fotografije elektronskog oblaka fotoionizovanog vodonikovog atoma u električkom polju. Na animaciji vidimo strukturu http://Hatomorbitala atoma vodonika putem detekcije fotoelektrona emitovanih tokom ionizacije laserskom svetlošću. |
| Pogledajte kako izgleda prva slika vodonikovog atoma: |
|
Može li se atom ipak videti golim okom? Atom je toliko mali da se ne može videti golim okom, ali se zato može snimiti! Fizičar Dejvid Nadlinger (David Nadlinger) sa Univerziteta u Oksfordu februara 2018. godine uspeo je da snimi jedan pozitivno naelektrisani atom stroncijuma u električnom polju. |
|
Kako mu je to uspelo? Zarobio je jedan atom stroncijuma u električnom polju koje potiče od dve metalne elektrode igličastih vrhova. Atom je osvetlio plavo-ljubičastim laserskim snopom svetlosti. Atom stroncijuma apsorbuje tu svetlost, a potom opet re-emituje svetlost dovoljno brzo da se može snimiti običnim fotoaparatom. |
|
Da li je to snimljen sam atom stroncijuma? Ne, nije. Fotografija je ipak posredna. Ovaj atom stroncijuma se vidi pošto prikazuje re-emitovanu svetlost! Bleda tačka nije prava veličina atoma stroncijuma! Zašto? Atom zapravo emituje svetlost lasera kojim je osvetljen i stvara sjaj koji je na stotine puta veći od radijusa atoma. |
|
Da li ste pokušali da vidite atome oko vas? Možda i jeste, ali naravno niste uspeli. Atomi su nevidljivi za naše oči, ali ako im pristupimo odgovarajućom opremom, možemo ih videti. Šta su tačkice na slici? Tačkice predstavljaju pojedinačne atome. Koliko je atoma prikazano na slici? Ima ih čak 27 000! |
|
Istraživači Kalifornijskog univerziteta u Los Anđelesu (Los Angeles) pronašli su način da stvore zadivljujuće detaljnu 3D rekonstrukciju nanočestica platine u atomskim razmerama: |
|
Kako možemo videti atome? Korišćenjem mikroskopa, ali ne optičkog koga obično srećemo u školi ili laboratoriji, već elektronskog mikroskopa, mogu se videti atomi. U elektronskom mikroskopu uzan snop elektrona zauzima mesto svetlosnih zraka. Zahvaljujući novim izumima naučnici su poslednjih godina puno toga iz „mikrosveta“ mogli videti. Dole su prikazane neke od fotografija mikrosveta snimljene pomoću elektronskog mikroskopa. |
|
Zašto atome ne možemo videti golim okom ili optičkim mikroskopima? Optički mikroskop koristi vidljivu svetlost, dok elektronski mikroskop koristi elektrone. Talasna dužina elektrona je znatno kraća od talasne dužine vidljive svetlosti (400-700 nm). Tako npr. kada su elektroni ubrzani potencijalnom razlikom od 100 kV (100 000 V), imaju talasnu dužinu od 4 pm (4.10-12 m). Zbog toga je i uvećanje kod elektronskog mikroskopa mnogo veće, te može biti i do 10 000 000 puta. Kod optičkog mikroskopa uvećanje ne može biti veće od 2500 puta. |
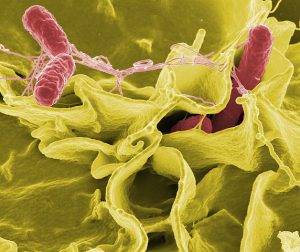 Wikimedia Commons (Public Domain) |
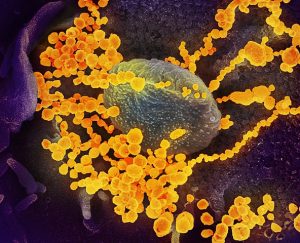 NIAID/Wikimedia Commons (CC BY 2.0) |
|
Više o fotografijama dobijenim pomoću elektronskog mikroskopa: |
|
Ako ste radoznali i želite da saznate kako radi elektronski mikroskop: |
|
Elektron i energija? |
||
|
Energija se može naći u elektronskim orbitalama atoma. Svaka orbita ima određenu energiju, a u zavisnosti od toga koliko energije poseduju, elektroni se nalaze na različitim orbitalnim nivoima. Elektron ne može da pređe na orbitalu sa većom energijom tako jednostavno. Za taj put mora da apsorbuje foton koji sadrži potrebnu količinu energije. Takođe može i u sudaru sa drugim česticama da uzme tačno toliko energije koliko mu treba za prelazak na viši nivo. Tek kada ima potrebnu energiju, to može uspešno d aizvrši. Naravno, elektroni se potom mogu vratiti na svoje početno energetsko stanje. Tada gube energiju, emitujući je u obliku elektromagnetnog zračenja, najčešće kao vidljivu svetlost ili toplotu. Elektroni mogu podeliti svoju energiju sa elektronima nekog drugog atoma u kovalentnoj vezi. |
|
Nakon što atom apsorbuje foton, foton nestaje. Ako je energija fotona dovoljna, elektron preuzima njegovu energiju i prelazi u više energijsko stanje. Dakle, elektron iz osnovnog stanja (niži energijski nivo) prelazi u pobuđeno stanje (viša energijski nivo). Dobivanjem energije oni prelaze u energijski viša stanja, pobuđena stanja. Tada atom postaje pobuđen. Ovi pobuđeni atomi su nestabilni i teže da se vrate u svoje osnovno energijsko stanje. Da bi se vratili u osnovno stanje moraju se osloboditi energije koju su dobili od fotona. Prikazane slike su samo veoma pojednostavljeni modeli, a ne realno stanje u atomu, jer se elektroni kreću haotično oko jezgra po tačno određenim energijskim stazama, a to je gotovo nemoguće prikazati crtežom. |
||
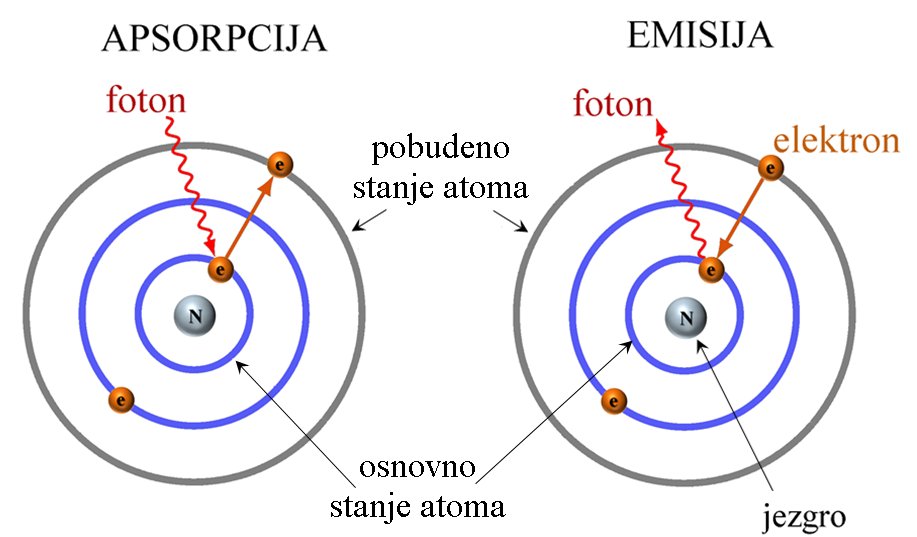 Prilagođeno od Francois~frwiki/Wikimedia Common (CC BY-SA 4.0 DEED) |
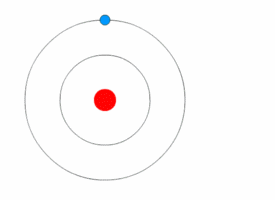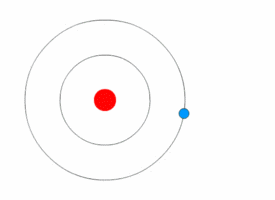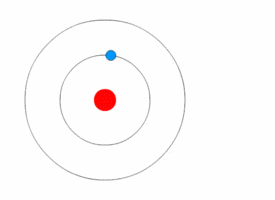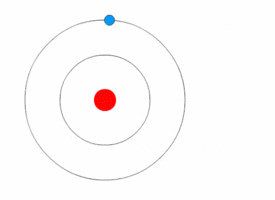 Kurzon/Wikimedia Commons (CC BY-SA 3.0 DEED) |
|
|
Da li elektroni u atomu mogu apsorbovati bilo koju energiju svetlosti? Ne mogu. Putanje po kojima se kreću elektroni oko jezgra nazivaju se energetski nivoi. Svaki energetski nivo ima tačno određenu energiju. Zamislite, dogovorili smo se da je ta energija negativna, upravo zato da bi elektron morao da primi energiju da bi prešao u viša energijska stanja. |
||
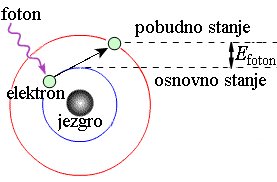 |
Da bi elektron prešao na viši energetski nivo, potrebno je da apsorbuje energiju koja odgovara razlici između dva energijska nivoa Ukoliko energija fotona nije jednaka razlici energija dva energetska nivoa, elektron ga neće apsorbovati i ne dolazi do prelaska na viši nivo, a foton će nakon sudara sa elektronom nastaviti svoje kretanje. |
|
|
A šta se dešava sa molekulima kada apsorbuju foton? Molekuli, kao i atomi, mogu da apsorbuju fotone samo ako njihova struktura ima energetsku razliku između nivoa koja odgovara energiji fotona. U suprotnom, molekul (ili atom) neće apsorbovati energiju fotona. Apsorpcijom fotona atom/molekul prelazi iz osnovnog stanja u pobuđeno stanje Jednom kada molekul apsorbuje foton, on može:
|
||
|
Kako su otkrivane tajne atoma: |
|
Poslušajte pesmicu o atomu: |
1.3.4. Elementarne čestice
|
Elementarne čestice su nedeljivi deo materije, bez oblika i unutrašnje strukture. To su najsitniji gradivni blokovi materije, od kojih je sačinjeno sve ono što postoji. Od čestica koje čine atom samo je elektron elementarna čestica. Elementarne čestice se u fizici opisuju standardnim modelom. Ovim modelom se uspešno objašnjavaju pojave koje su uočene eksperimentima sa velikim akceleratorima. |
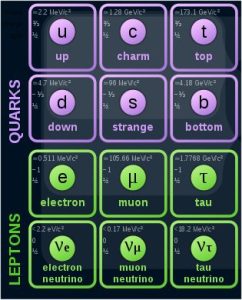 Prilagođeno od Cush/Wikimedia Commons (CC0 1.0) Kvarkovi su čestice od kojih su izgrađene protoni, neutroni i mnoge druge čestice. Leptoni su elementarne čestice koje ne prave druge složene čestice, ali učestvuju u fizičkim procesima. |
Koja je bila prva elementarna čestica koja je otkrivena? Bio je to elektron, otkriven 1897. godine. Zatim su otkrivane i druge elementarne čestice, poput fotona. Do danas je otkriveno oko 300 elementarnih čestica. Koje su najpoznatije elementarne čestice? To su elektroni, fotoni, kvarkovi i Higsov bozon (Božija čestica). Da li postoje antičestice? Da, postoje. Skoro svaka čestica ima svoju antičesticu, čije su karakteristike suprotne. Mada postoje i takve čestice koje su same sebi antičestice, kao što je npr. foton. |
|
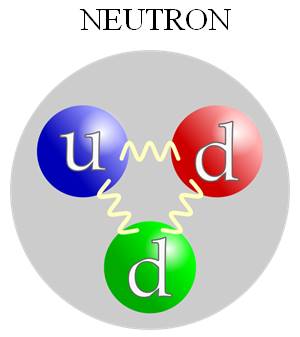
Kako je otkriveno da protoni nisu elementarne čestice? Kada su prvi put sudarili ubrzane elektrone sa protonima, naučnici su zapazili da su se elektroni odbili od tri mala jezgra unutar protona. Ova malena jezgra, manja od protona, nazvana su kvarkovi. Otkriće kvarka značilo je da protoni i neutroni nisu elementarne čestice, već da su sastavljeni upravo od kvarkova. Po tri kvarka gradi svaki od protona ili neutrona (vidi sliku dole). Kvarkovi su toliko mali, manji od 10-18 m*, da ih ne možemo videti svojim očima, ali ono što nas obaveštava da oni postoje su efekti iz eksperimenata. Eksperimenti su pokazali da zasad ne postoje slobodni kvarkovi tj. da postoji samo jedan kvark u čestici. Obično tri kvarka grade česticu (npr. proton i neutron). * |
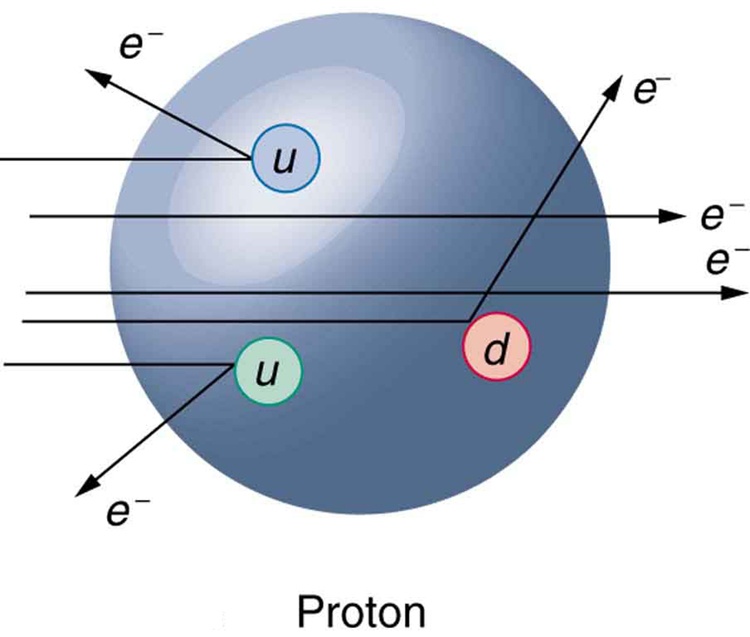 OpenStax, College physics (CC BY 4.0 DEED) |
Kako je otkriveno da protoni nisu elementarne čestice? Kada su naučnici prvi put (1967.) sudarili elektrone velikih energija (20 GeV) sa protonima, zapazili su da su se elektroni odbili od tri mala jezgra unutar protona. Ova malena jezgra, manja od protona, nazvana su kvarkovi. |
|
Otkriće kvarka značilo je da protoni i neutroni nisu elementarne čestice, već da su sastavljeni upravo od kvarkova. Po tri kvarka gradi svaki od protona ili neutrona. Kvarkovi su toliko mali manji od 10-18 m*, da ih ne možemo „videti“ svojim očima, ali ono što nas obaveštava da oni postoje su efekti iz eksperimenata. Eksperimenti su pokazali da zasad ne postoje slobodni kvarkovi tj. da postoji samo jedan kvark u čestici. Obično tri kvarka grade česticu (npr. proton i neutron). *10-18 m=0.000 000 000 000 000 001 m |
|
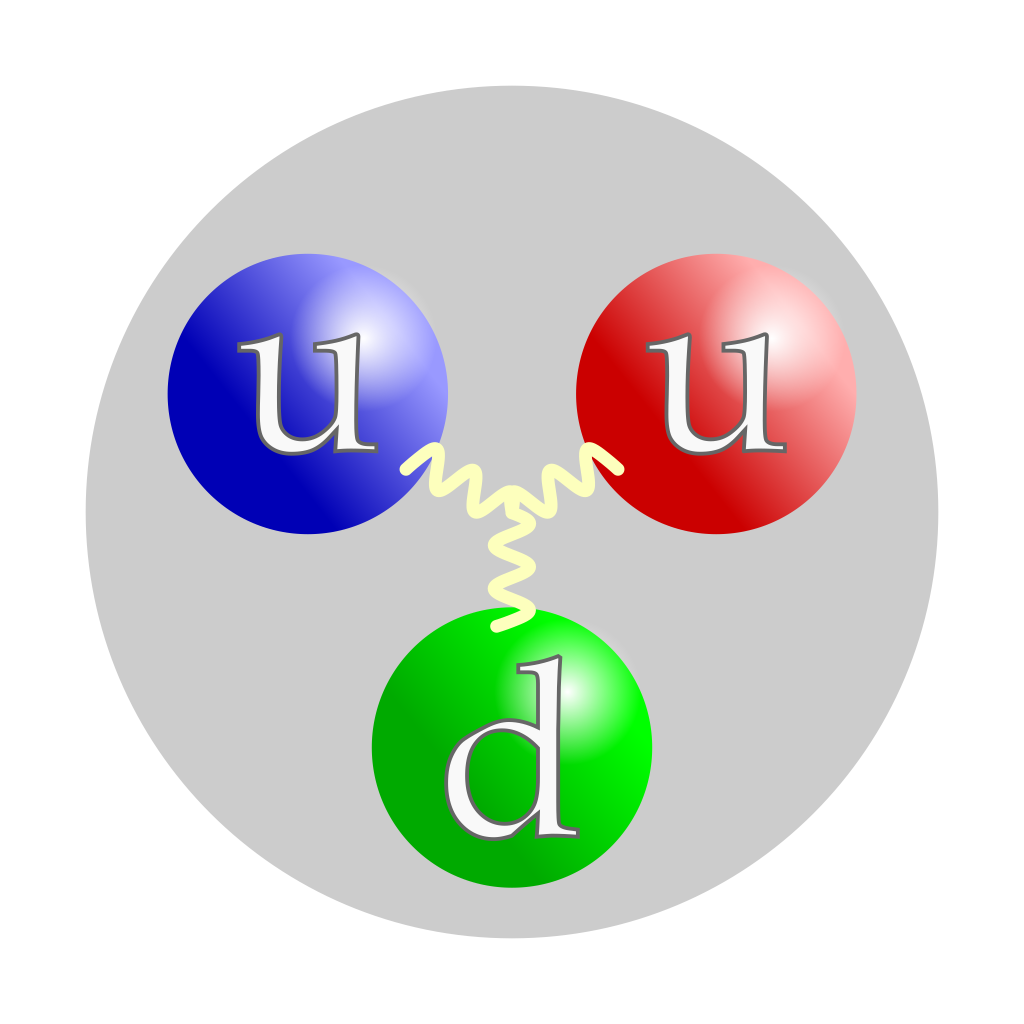 Ukupno naelektrisanje je: +2/3+2/3-1/3=1 Jacek rybak/Wikimedia Common (CC BY-SA 4.0 DEED) |
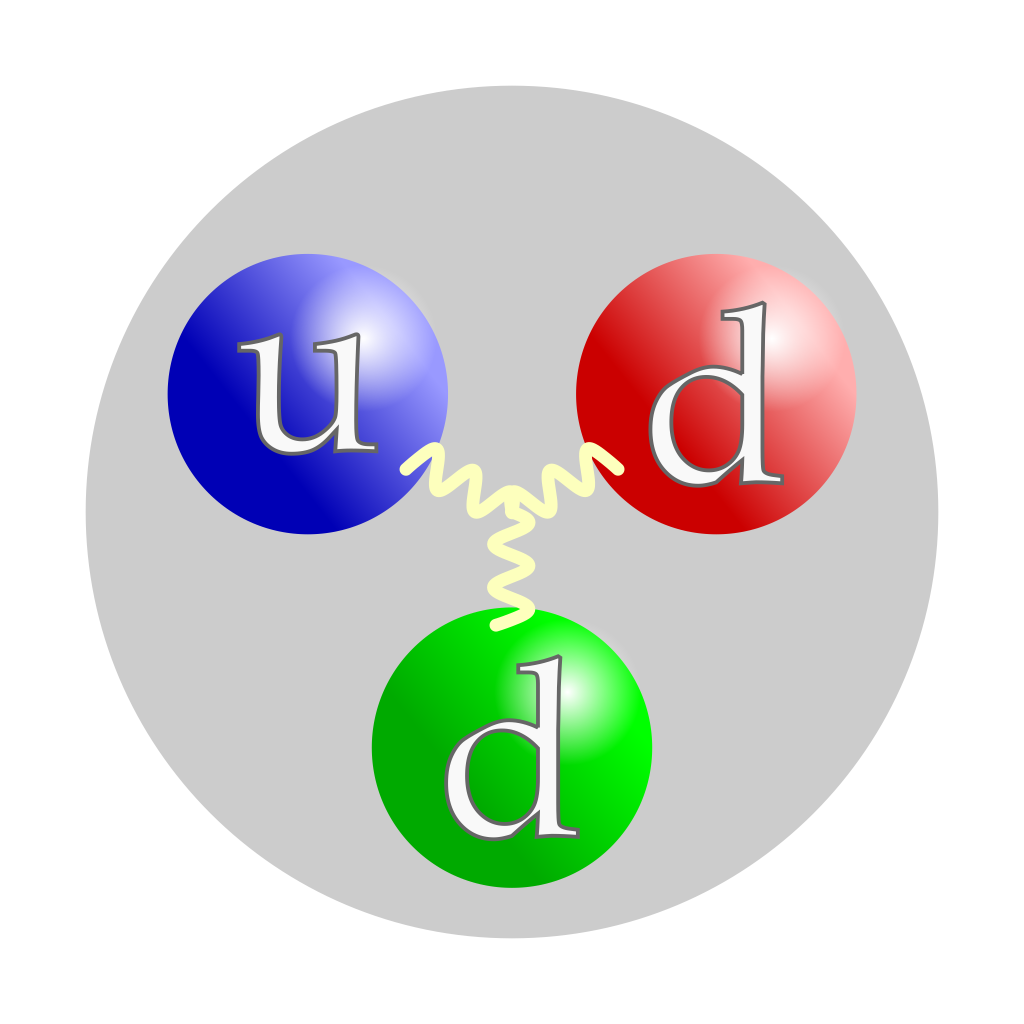 Ukupno naelektrisanje je: +2/3-1/3-1/3=0 Jacek rybak/Wikimedia Common (CC BY-SA 4.0 DEED) |
|
Čestice sastavljene od kvarkova, vezanih zajedno jakom silom, nazivaju se Hadroni. |
|
Saznajte više o kvarkovima: |
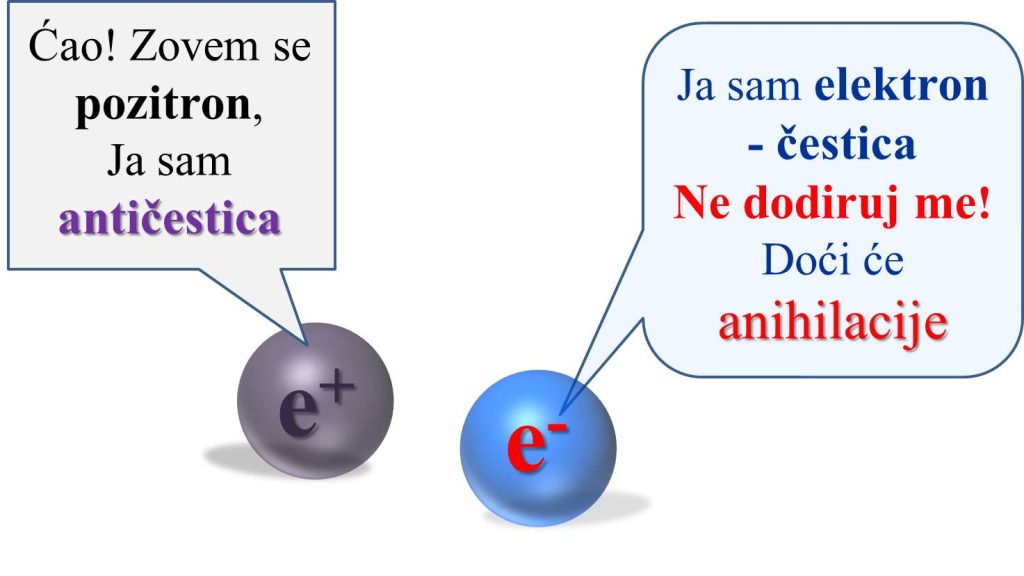
1.3.5. Čestice i antičestice
|
Za svaku česticu u prirodi postoji odgovarajuća antičestica sa istom masom, ali suprotnim naelektrisanjem. Postoji i izuzetak, a to su čestice bez mase — bozoni. Tu spada na primer foton. |
|
 |
Pozitron (antielektron) je antičestica elektronu, kao što je elektron antičestica . Pozitron je uglavnom jednak elektronu, ali je suprotnog naelektrisanja (pozitivno je naelektrisan). |
 |
Antiproton je antičestica protonu i ima negativno naelektrisanje (-). |
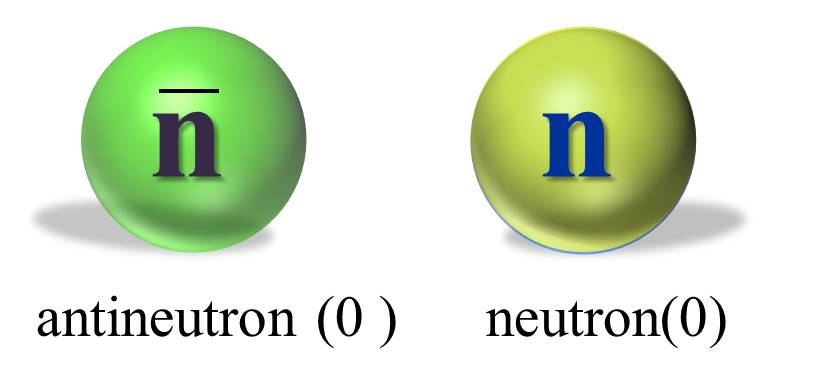 |
Antineutron je antičestica neutronu. Neutroni i antineutroni nemaju naelektrisanje. U čemu je razlika između antineutrona i neutrona? Neutron i antineutron nisu elementarne čestice, te imaju strukturu. Neutron je sačinjen od kvarka, dok antineutron čine antikvarkovi. |
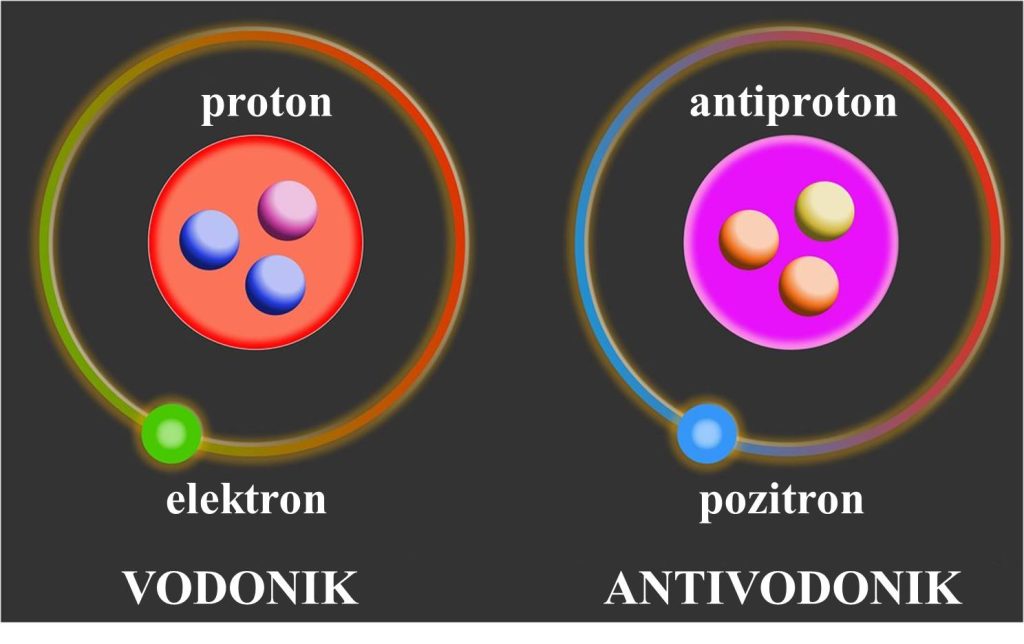 |
Antičestice mogu graditi antimateriju. Primer: atomi antivodonika i vodonika. Antivodonik je sastavljen od negativno naelektrisanog antiprotona oko koga kruži pozitivno naelektrisan pozitron. Vodonik se sastoji od jezgra koga čini proton, pozitivno naelektrisana čeastica. Oko jezgra kruži negativno naelektrisan čestica elektron. |
|
Da li su naučnici uspeli da na detektuju antimateriju na Zemlju? |
|
|
Naučnici u CERN-u (Evropska organizacija za nuklearna istraživanja) 2011. uspeli su da uhvate atome antivodonika (sačinjen od pozitrona i antiprotona). Uspeli su da ih zadrže 1000 s (16 min i 40 s). Da bi se mogao detektovati antivodonik, potrebno ga je „zarobiti“ u magnetno polje. Antineutron i antiproton su već ranije identifikovani 1955. godine (Univerzitet Berkli, SAD).Ni tu se naučnici nisu zaustavili, uspeli su 2016. godine da izmere emisiju svetla antimaterije (antivodonika). Zašto je to značajno? Zato što može pomoći fizičarima da reše misteriju moderne fizike — zbog čega u Svemiru postoji mnogo više materije od antimaterije? |
|
 Rorokpal/Wikimedia Commons (CC BY-SA 4.0) |
|
|
Gde je nestala antimaterija? |
1.3.6. Fotoni
 NASA/Sonoma State University/Aurore Simonnet/Wikimedia Commons (CC BY 2.0) |
Foton je elementarna čestica. To je malena čestica svetlosti, toliko mala da se pojedinačno ne može videti. Snop svetlosti sadrži bezbroj fotona. Nije samo svetlost sačinjena od fotona, fotoni čine elektromagnetno zračenje poput x-zraka, ultraljubičastih zraka, infracrvenih zraka, mikrotalasa, radiotalasa. |
|
Fotoni = čestice elektromagnetnog zračenja. |
|
Fotoni su ti koji nam omogućavaju da vidimo! Naše oči interaguju sa fotonom. Kada foton padne na oči, dolazi do apsorpcije fotona u oku, nakon čega se optički signal pretvori u električni signal koji se prenosi do malog mozga. Tu se formira slika i dobijemo osećaj da vidimo npr. oblake, kuće, automobile. Da li ponekad razmišljate o tome kako vidimo? |
|
Koje su osobine fotona? Foton je elementarna čestica koja je:
Materija može apsorbovati fotone, pri čemu se svetlosna energija fotona transformiše u toplotu (toplotnu energiju). Fotoni se u vakuumu kreću brzinom svetlosti (oko Čini li vam se to kao mnogo ili malo vremena za put od Zemlje do Sunca? |
|
Šta određuje boju fotona? To je njegova frekvencija. Inače u nauci ne koristimo pojam boje. Boja obično iskazujemo frekvencijama ( |
|
Energija fotona:
*jedinica za energiju je džul (J). |
Da li svi fotoni imaju istu energiju? Nemaju svi fotoni istu energiju. Njihova energija zavisi od frekvencije. Najveću energiju imaju fotoni koji čine gama zrake, pošto imaju najveću frekvenciju, a najmanju fotoni koji čine radiotalase, pošto imaju najmanju frekvenciju. Što se tiče vidljive svetlosti, plava svetlost ima veću frekvenciju od crvene. Stoga, „plavi“ foton ima veću energiju od „crvenog“ fotona.
|
|||
|
Da li znate koja je jedina „stvar“ koja sadrži fotone? To je svetlost! |
|
Saznajte još ponešto o fotonu: |
|
Kvantni svet kroz muziku: |
1.3.7. Prazan prostor
|
Započnimo sa pitanjem: Šta je prostor? To je ono u čemu se prostire materija. A šta je prazan prostor? Jednostavno rečeno, to je prostor u kome nema atoma (materije). Prazan prostor u atomima? Atomi koji se nalaze svuda oko nas većim delom se sastoje od praznog prostora. Tako da svi atomi od kojih su napravljena tela oko nas, pa čak i mi, su uglavnom prazan prostor. Zamislite, atom vodonika čini oko 99.9999999999996 % prazan prostor. |
|
Ako je materija sačinjena od uglavnom praznog prostora, da li u telu čoveka postoji prazan prostor? Atomi sačinjavaju naše telo. Već smo naučili da atome uglavnom čini prazan prostor. Dakle, i u nama postoji prazan prostor. Da ga nema, ljudi bi bili sitniji, a čitava ljudska vrsta bi se mogla smestiti u kocku šećera. |
 Prilagođena fotografija juana pablo rodriguez/ Unsplash (unsplash Licence) |
|
Verovatno sada postavljate pitanje: Zbog čega tada ne možemo proći kroz zid ili vrata, a da ih ne otvorimo? Razlog je to što prazan prostor nije apsolutno prazan, već je ispunjen raznim poljima poput elektromagnetnog i gravitacionog polja. Elektroni stalno „zuje“ i kao da su u nekoj vrsti oblaka. Dva elektrona ne mogu biti istovremeno u istom prostoru. Dva tela ne mogu stajati na istom mestu! Figurativno: „Atomi zida stoje“ tamo gde je zid. Ako bi mi krenuli prema zidu, naši atomi putuju sa nama. Približavanjem zidu dolazimo do situacije da bi naši atomi trebali proći kroz mrežu atoma zida. Trebalo bi se dogoditi da naši atomi nađu međuprostor kroz koji bi se provukli. Međutim, to nije realno moguće, mada unutar svih atoma ima puno praznog prostora. Atomi imaju svoje granice. Jezgro i elektroni svoj međuprostor ne prepuštaju nikome. Kada se atom premesti, zajedno sa njim se premešta i taj njegov prazan prostor. Ipak nam trebaju vrata! |
|
Prazan prostor, zid i vi: |
|
Da li se ti međuprostori i atomi nekako manifestuju? Zamislite punu šolju toplog čaja koji hoćemo da zasladimo. Dodamo punu kašiku šećera, a čaj se ne preliva preko ruba šolje. Ovo znači da u čaju postoji osim molekula vode i međuprostor (prazan prostor) između molekula vode. Šećer popunjava ovaj prazan prostor. |
|
Kako se znanja o atomu neprekidno dopunjuju, 2012. godine otkriveno je i postojanje Higsovog polja. Ovo polje je popularno poznato kao polje koje generiše Higsov bozon „Božija čestica“. |
|
Otkud ime „Božija čestica“? Za Higsov bozon, često se koristi i ime „Božija čestica“. Fizičar Leon Laderman (Leon Ledermen), dobitnik Nobelove nagrade za fiziku (1988. godine), napisao je knjigu na temu Higsovog bozona. Da bi se knjiga bolje prodavala, po nagovoru izdavača, nazvana je Božija čestica. Ovaj naziv čestice nema nikakve veze sa fizikom, ali je potpuno prihvaćeno u medijima i širokoj javnosti. Naučnici više vole da koriste ime Higsov bozon. |
|
Higsov bozon kroz animacije: |
|
Prazan prostor u svemiru? Kada pogledamo noćno nebo ispunjeno zvezdama, vidimo i tamnu pozadinu. Tamna pozadina je prostor koji se obično smatra praznim. Naučnici smatraju da ne postoji prostor u kome ne postoji nijedan molekul gasa ili čestica prašine. U praznom prostoru uvek vrlo mali broj atoma i čestica prašine „poskakuje okolo“. Vidimo li svetlost Sunca kad pogledamo u taj „prazan“ prostor? Vidimo. Čujemo li reakcije, sudare u tom „praznom“ prostoru? Ne čujemo. Kroz ovaj prostor slobodno se može kretati svetlost, ali ne i zvuk. |
|
Zašto se zvuk ne prostire u svemiru? Zbog toga što je zvuk mehanički talas, a on se prenosi kroz materijalnu sredinu kao što je vazduh, tečnost i čvrsto telo. Dakle, moraju postojati tela koja će preneti energiju zvuka. U praznom prostoru svemira ima zanemarivo malo molekula i atoma, pa se zvuk ne može prenositi. Svetlost se može prenositi svemirom jer je elektromagnetni talas koji za kretanje ne treba nikakvo telo. Dakle, elektromagnetni talasi kao što su radiotalasi, ultraljubičasto zračenje, infracrveno zračenje itd. mogu da putuju kroz svemir. Svaka letelica (astronauti u svojim kacigama) ima antene, prijemnik i predajnik za radiotalase. |
|
Naučite više o talasima: |