3. KAKO JE ZEMLJA DOBILA VODU
3.3. Taj čudesni molekul — voda!
|
Zamislite, molekul vode se ponaša potpuno drugačije od većine drugih hemijskih jedinjenja. Voda je sastavni deo našeg života i smatramo je neophodnom, potpuno svakidašnjom tečnošću, a ona je ipak toliko drugačija! |
|
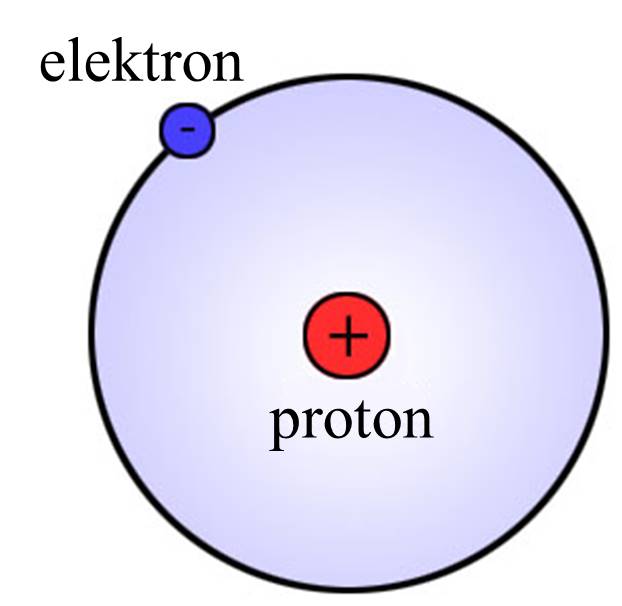
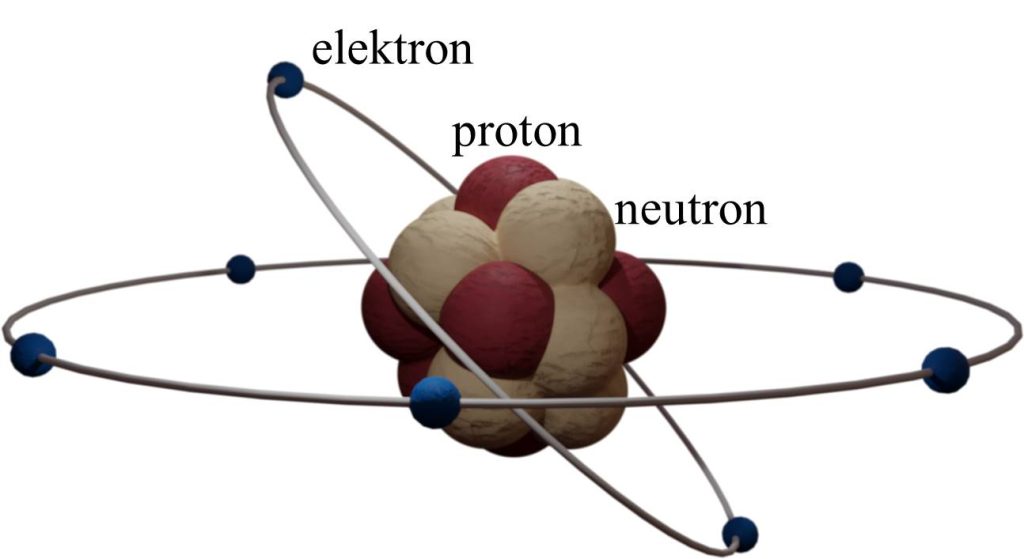
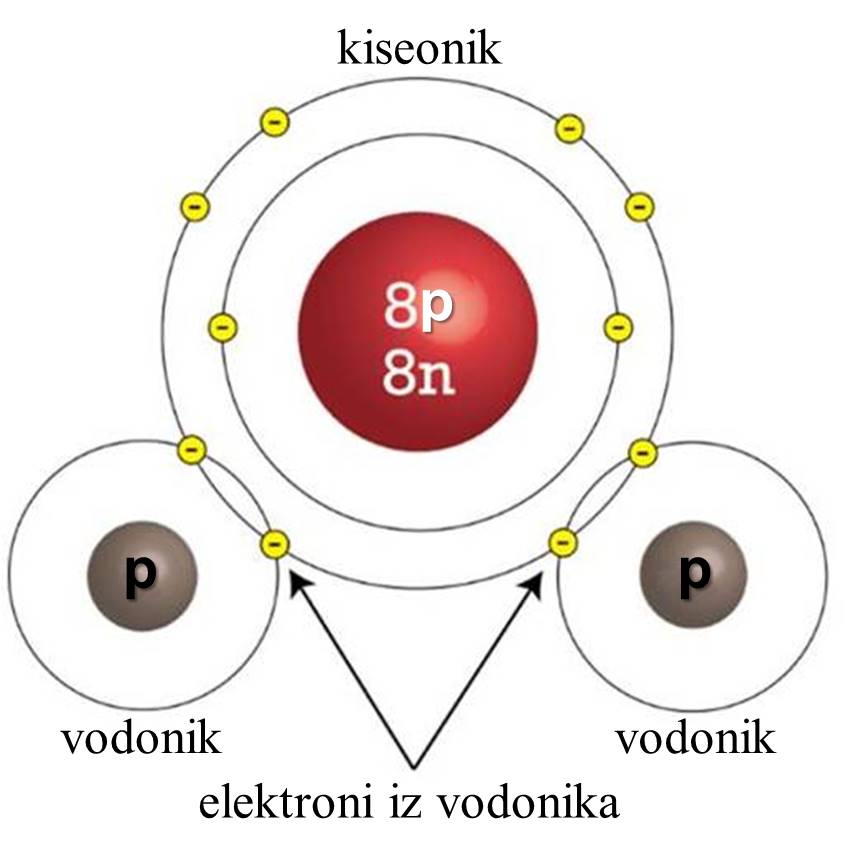
Zašto su elektroni u spoljašnjoj ljusci bitni? Svi atomi teže da imaju popunjene spoljašnje orbitale, kao što to imaju inertni gasovi (helijum, neon, argon i drugi). To je i razlog da atomi bez popunjene spoljašnje ljuske „stupaju u kontakt“ sa drugim atomima, kako bi od njih dobili ili se odrekli elektrona. Tako kiseoniku nedostaju još dva elektrona, pošto je elektronska konfiguracija* od osam elektrona u spoljašnjoj orbitali stabilna, te kiseonik teži da ima još dva elektrona. Ali tu je i atom vodonika, koji takođe teži da ima još jedan elektron u spoljašnjoj ljusci. Zbog toga atomi vodonika i kiseonika dele elektrone i tako formiraju kovalentnu vezu. Tako sva tri atoma u spoljašnjoj ljusci imaju popunjene orbitale i istovremeno je nastao molekul vode. *Elektronska konfiguracija pokazuje raspored elektrona u atomu po njegovim orbitalama. Prva orbitala može imati dva elektrona, dok druga može imati osam elektrona. |
|
 Prilagođeno od Jia Ilu/Wikimedia Commons (Public Domain) |
 Prilagođeno od Wikimedia Commons (CC BY-SA 4.0) |
 Prilagođeno od Christopher AuYeung/CK-12 Foundation (CC BY-NC 3.0) |
|
Kovalentna veza je jedna vrsta kemijske veze. Ona nastaje udruživanjem dva atoma, pri čemu se stvara zajednički elektronski par koji povezuje atome. Atomi dele elektrone i ovaj zajednički elektronski par deluje kao „lepak“ koji drži jezgra zajedno. |
|
Naučite više o kovalentnoj i jonskoj vezi: |
| Kakve su veze između molekula vode? |
|
Molekuli vode se povezuju međusobno preko vodonika, vodoničnim vezama. Ova veza ima veliki uticaj na fizičke karakteristike vode u sva tri agregatna stanja. Poznato je da se suprotna naelektrisanja privlače. Između delimično pozitivno naelektrisanih atoma vodonika i delimično negativno naelektrisanih atoma kiseonika susednih molekula dolazi do jakog privlačenja. Ova mala sila privlačenja naziva se vodonična veza, pošto ju je obrazovao atom vodonika. Vodonične veze se lako formiraju kada se dva molekula vode približe, ali se isto tako lako raskidaju kada se molekuli vode udaljavaju. |
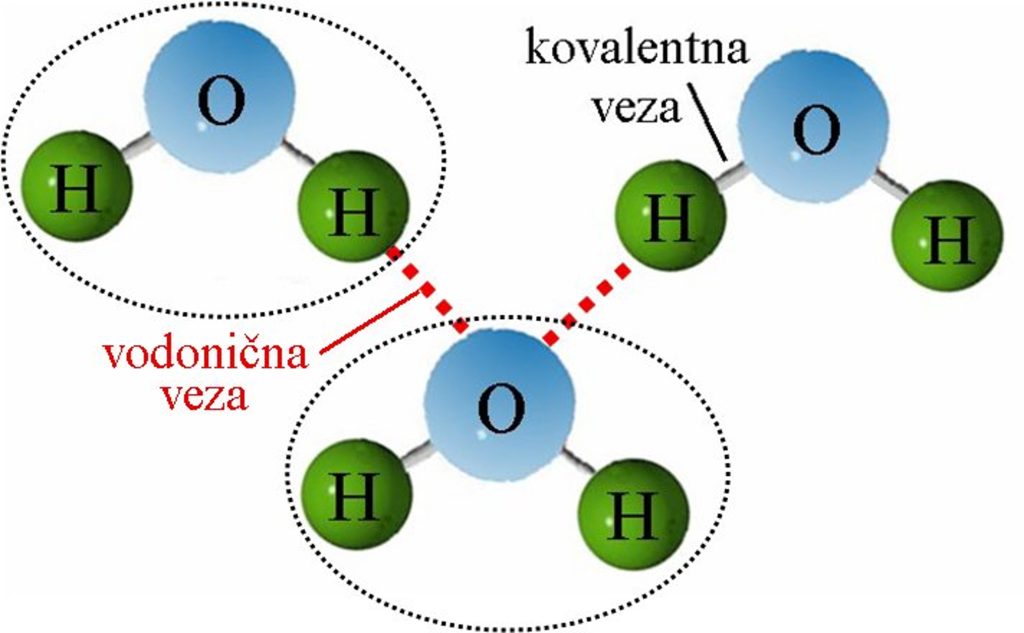 |
Dakle, kovalentna veza nastaje među atomima, a vodonična među molekulama. Vodonična veza je slabija od kovalentne. |
|
Kako dolazi do stvaranja vodonične veze? |
|
Kakva je raspodela elektrona u molekulu vode? |
|
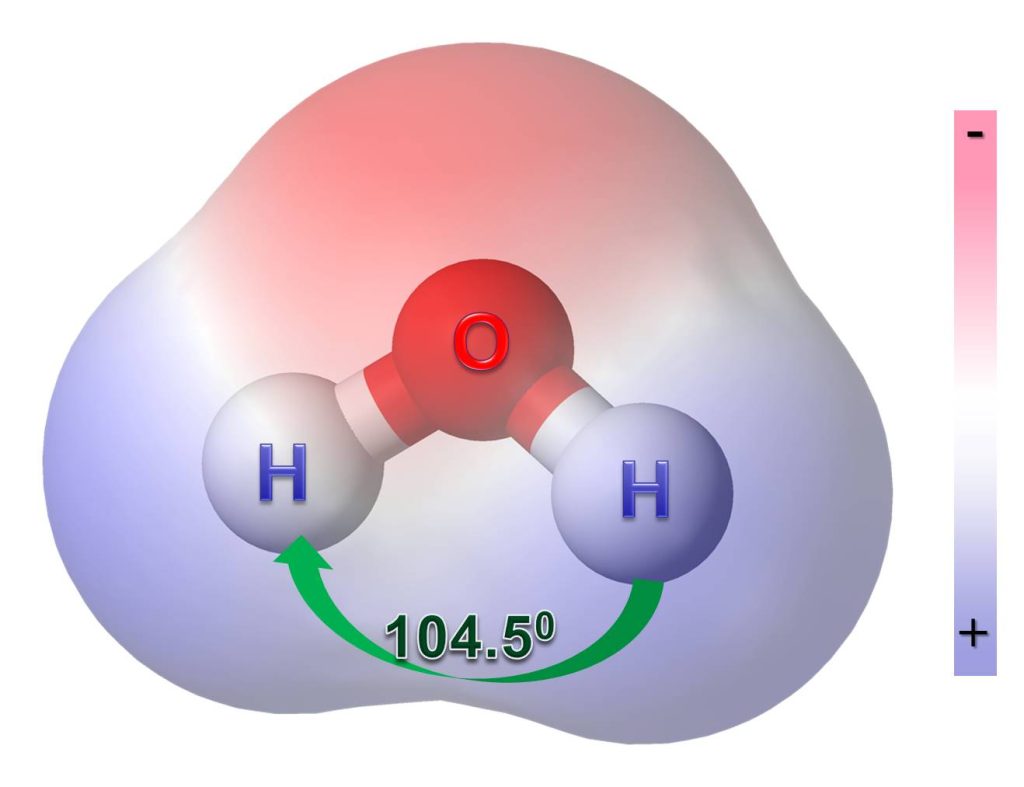  |
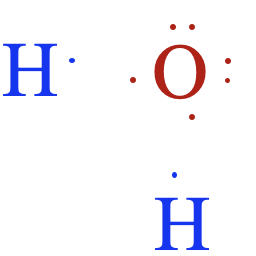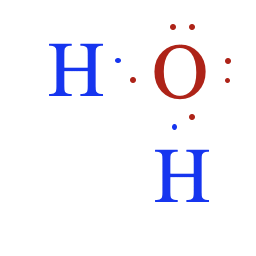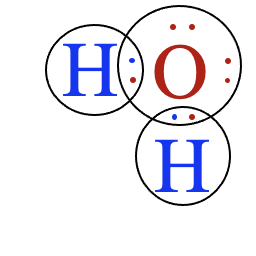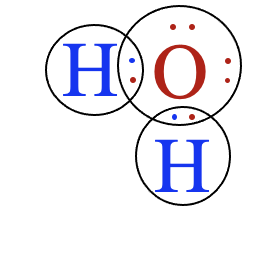
Raspodela elektrona u molekulu vode nije jednaka. Dva atoma vodonika vezana uz kiseonik međusobno čine ugao od 104.5o. Zašto? Elektroni se ne dele ravnopravno — jedan atom (kiseonik) provodi više vremena sa elektronima od drugog atoma (vodonik). Zbog toga je atom kiseonika delimično negativno naelektrisan, a atom vodonika nosi delimično pozitivno naelektrisanje. Baš ta nejednaka raspodela elektrona čini da je voda polaran molekul*. *Polarnost je neravnomerna raspodela naelektrisanja unutar molekula. |
|
Kako polarnost utiče na vodu? |
|
Koje su to jedinstvene osobine vode? |
|||
|
Voda ima jedinstvene fizičko-hemijske osobine, koje su doprinele da se život na Zemlji razvije:
Krenimo redom i ukratko opišimo ove jedinstvene osobine vode. |
|||
 Julio Miguel A Enriquez and Monica Muñoz/Wikimedia Commons (CC BY-SA 4.0 DEED) |
 Julio Miguel A Enriquez and Monica Muñoz/Wikimedia Commons (CC BY-SA 4.0 DEED) |
 Julio Miguel A Enriquez and Monica Muñoz/Wikimedia Commons (CC BY-SA 4.0 DEED) |
|
|
Voda se u prirodi javlja u sva tri agregatna stanja |
|
Voda je jedina supstanca u prirodi koja na atmosferskoj temperaturi i pritiscima postoji u sva tri agregatna stanja: čvrstom, tečnom i gasovitom. U čvrstom agegatnom stanju voda se javlja u vidu leda (glečeri, sneg, grad). Vodu kao tečnost susrećemo u kišnim kapima, u vidu rose, u obliku reka, jezera, mora, okeana. Najčešće tečnost u svakodnevnom životu zovemo samo voda. Vodena para nije ništa drugo nego voda u gasovitom stanju. Njenu prisutnost u atmosferi merimo vlažnošću. |
 Petrovaradinska tvrđava, Novi Sad, Srbija |
|
Šta je vlažnost vazduha? |
|
Da li ste ikada čuli da neko u vašoj okolini kaže: „nije toliko toplo, koliko je vlažno“? Verovatno ste ponekad imali i osećaj da znoj „curi“ sa vas. Osećate da ste mokri, ali ne vidite nikakvu vodu u vazduhu! Ipak, zaista postoji voda u vazduhu, ali je u obliku gasa. Ova vrsta vode se naziva vodena para. Ona se ne može videti, ali se može osetiti. |
|
Odakle potiče vodena para? |
|
Vodena para potiče od vodenih površina, biljnog pokrivača i živih bića na Zemlji. |
|
Kako znamo koliko vodene pare ima u vazduhu? |
|
Količinu vodene pare u vazduhu opisujemo vlažnošću vazduha. Za procenu vlažnosti vazduha najčešće se koriste relativna i apsolutna vlažnost vazduha. |
|
Apsolutna vlažnost vazduha:
|
Apsolutna vlažnost predstavlja masu vodene pare sadržane unutar neke zapremine na datoj temperaturi. Jedinica za meru apsolutne vlažnosti je g/m3 . |
|
Relativna vlažnost vazduha
|
Vlažnost vazduha se najčešće izražava u procentima (npr. 30%, 50%). To je relativna vlažnost vazduha. Ona nam govori o odnosu mase vodene para u vazduhu i najveće mase vodene pare koju vazduh može da primi pri određenoj temperaturi. Hajde da napravimo jedno poređenje — Zamislite da ste čašu sa vodom napunili do jedne trećine, dakle čaša sadrži 30% vode od ukupne količine vode koja može biti u njoj. Stoga, ako je relativna vlažnost 30%, to znači da masa vodene pare Ako u vazduhu nema vodene pare, relativna vlažnost je 0%, i to je onda suv vazduh. |
 |
Manja temperatura Manje molekula vodene pare u vazduhu. Manja vlažnost Pri manjim temperaturama vazduh može primiti manje molekula vodene pare nego pri većim temperaturama. |
 |
Veća temperatura Veći broj molekula vodene pare se nalazi u vazduhu. Veća vlažnost Pri većim temperaturama vazduha vazduh može primiti više molekula vodene pare nego pri nižim temperaturama. |
|
Anomalija vode, šta je to? |
|
 Georges Nijs/Wikimedia Commons (CC BY 2.0) |
U hladnim mesecima led pluta na površini tečne vode, umesto da potone. Za vodeni svet je presudno da led pluta na površini tečnosti, tako da život može opstati pri velikoj hladnoći. Zbog čega je tako? Odgovor je jednostavan — zbog anomalije vode. To je najčudnija karakteristika vode: da ima najveću gustinu u tečnom stanju na temperaturi od +4 0C, a ne kada je u čvrstom stanju (led). |
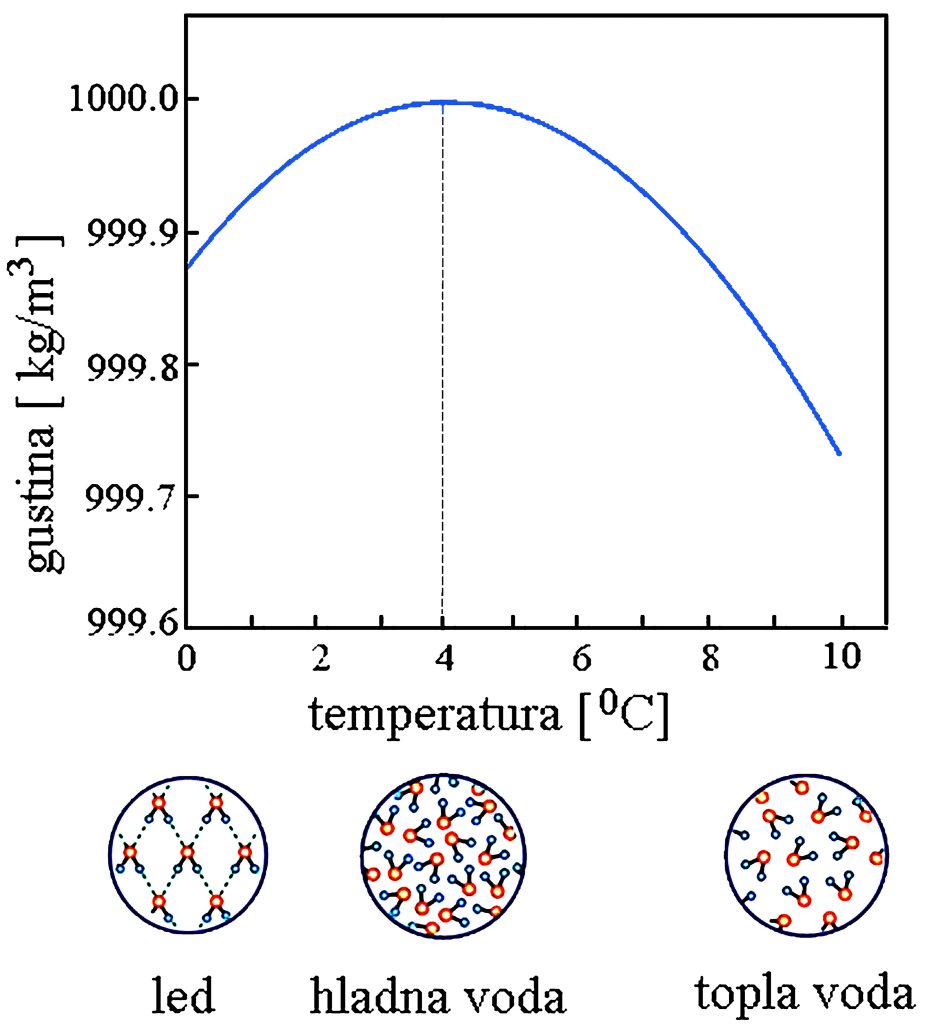 Prilagođeno od Wikimedia Commons (Public Domain) |
Šta je uzrok ovakvog ponašanja vode? U ledu se molekuli vode nalaze u kristalnoj rešetki, koja sadrži mnogo praznog prostora. Topljenjem leda, ova struktura se postepeno narušava, dolazi do kidanja vodoničnih veza, te se molekuli mogu kretati, čime se povećava gustina tečnosti. Gustina vode dostiže svoju najveću vrednost na temperaturi +4 0C. Daljim povećavanjem temperature, iznad +4 0C, javlja se i druga pojava, ali suprotnog smera. Povećavanjem temperature molekuli vode imaju sve veću energiju, brže se kreću i sve se više udaljavaju jedan od drugog. Posledica je opadanje gustine vode. |
|
Hajde da sada ohladimo vodu. Hlađenjem vode njena temperatura se smanje, molekuli vode postaju sve sporiji i gustina vode se povećava. Međutim, kada temperatura padne ispod +4 0C, kretanje molekula vode se značajno smanjuje i to omogućava stvaranje vodoničnih veza. Vodonične veze počinju da šire prostor između molekula uzrokujući ekspanziju u zapremini. Gustina postaje manja. |
|
|
Zašto led pluta na vodi? |
|
Voda je univerzalan rastvarač. |
|
 Cris 73/Wikimedia Common (CC BY-SA 3.0) |
Zahvaljujući svojoj polarnosti voda rastvara mnogo više supstanci od bilo kog drugog rastvarača. Pogledajmo kroz primere koliko je za život značajno ova svojstvo vode! Rastvoren vazduh u vodi omogućava disanje životinjama koje žive u njoj. Mnoge vodene zajednice zavise od kiseonika koji se nalazi u vodi. Bez dovoljno kiseonika one mogu da nestanu. Čak i male promene u koncentraciji rastvorenog kiseonika značajno utiču na njih. Voda rastvara hranljive materije (minerale iz zemljišta) i tako omogućava biljnom svetu njihovo korišćenje. Biljke pomoću korena upijaju rastvorene hranljive materije da bi stvorile druga jedinjenja. Voda rastvara i vodotopive molekule u nekim stenama (soli), te je tokom geoloških doba morska voda postala slana. Isparavanjem morske vode dobija se so. |
|
Pogledajte kako izgleda rastvaranje lekova u vodi: |
|
Voda ima visok specifičan toplotni kapacitet. |
|
|
Specifični toplotni kapacitet
|
Šta je specifični toplotni kapacitet? Da bi neku supstancu zagrejali (ili ohladili), potrebno je dovesti (ili odvesti) određenu količinu toplote. U praksi se često koristi specifični toplotni kapacitet, veličina koja predstavlja toplotni kapacitet po jedinici mase. Specifični toplotni kapacitet je količina toplote koju je potrebno dovesti jedinici mase (1 kg) da bi se temperatura povećala za jedan Celzijusev stepen (10C), |
|
Koliki je toplotni kapacitet vode? |
|
|
Voda ima visok specifičan toplotni kapacitet. To znači da se velike količine toplote mogu skladištiti u tečnosti pre nego što proključa (na 100 °C). Specifični toplotni kapacitet vode (tečnosti) iznosi 4180 J/(kgK), dok za gvožđe iznosi 460 J/(kgK). Teorijski to znači da bismo zagrejali 1 kg vode za 1 K (1 °C) trebamo dodati vodi 4200 J toplote. Sa druge strane, da bi zagrejali jednaku masu gvožđa za istu promenu temperature, trebamo dodati gvožđu samo 460 J toplote. Dakle, za jednake mase vode i gvožđa vodi je potrebno dovesti devet puta više toplote da bi im se temperatura povećala za isti iznos. Potpuno je drugačija situacija u prirodi. Za isti iznos Sunčeve toplote, koja dolazi na Zemlju, gvožđe će se mnogo više zagrejati od vode, upravo zato što gvožđe ne može uskladištiti velike količine toplote kao voda. Voda je značajna za život na Zemlji jer može apsorbirati puno veće količine toplote nego gvožđe, pesak ili kamen. Primer Leti, kad je temperatura vazduha iznad 40 °C, gvožđe i kamen će primiti jednako toplote kao i voda. Ipak, zbog malog specifičnog toplotnog kapaciteta gvožđa i kamena, temperature gvožđa i kamena će biti mnogo veće od temperature vode. Zato je leti, tokom toplog dana na plaži, teže hodati po vrućem kamenju ili pesku, nego plivati u osvježavajućem moru. |
|
Zbog čega voda ima velik toplotni kapacitet? |
|
|
Razlog za to su vodonične veze između molekula. Kod drugih tečnosti dovedena energija povećava kretanje između molekula, te se tako povećava se temperatura. To nije slučaj sa vodom. Kada voda apsorbuje energiju, dovedena energija koristi se za razbijanje vodoničnih veza i molekuli vode mogu slobodno da se kreću, tako da su vodeni rastvori, zahvaljujući vodoničnim vezama, izuzeti od velikih promena temperature. Šta se dešava kada se temperatura vode smanjuje? Kada se temperatura vode smanjuje, dolazi do formiranja vodoničnih veza i oslobađa se znatna količina energije. |
|
Zašto je bitan visok toplotni kapacitet vode? |
|
|
Visok toplotni kapacitet vode omogućava vodi da apsorbuje ili otpušta veliku količinu toplote u odnosu na male promene svoje temperature. Otpornost na nagle promene temperature, čini da je voda odlično stanište za organizme, omogućavajući im da prežive bez velikih temperaturnih promena. Takođe, visoki toplotni kapacitet vode doprinosi i visokoj tački ključanja, te omogućava vodi da se održi u tečnom stanju za većinu bioloških procesa. Visok toplotni kapacitet vode čini je otpornom na temperaturne promene, a to omogućava životnim formama da održavaju relativno konstantne unutrašnje temperature. Visok toplotni kapacitet doprinosi i visokoj tački ključanja, pomažući vodi da se održi u tečnom stanju za većinu bioloških procesa. Kako se većina organizama uglavnom sastoji od vode, visok toplotni kapacitet omogućava i regulisane unutrašnje temperature tela. Primer Kada je hladno, dok skijate ili se igrate na snegu, temperatura vašeg tela ne pada drastično na istu temperaturu kao što je spoljna. Zahvaljujući visokom toplotnom kapacitetu vaše telo (kao i druge toplokrvne životinje) koristi vodu za ravnomerniju raspodelu toplote u telu. Voda prenosi toplotu sa toplijih na hladnija mesta, te naše telo održava ravnomernu temperaturu. Način na koji voda to radi u našem telu je sličan sistemu za hlađenje kod automobila. |
|
Gde se sve nalazi voda? |
||
 Fotografisao Mladen Franko |
Voda se nalazi na:
|
|
|
Zavirite u unutrašnjost Križne jame pomoću fotografija. Ona je poznata po mnogim čistim podzemnim jezerima. U njoj živi čak 44 vrsta živih organizama! Križna jama je četvrta po veličini na svetu među pećinskim sistemima. |
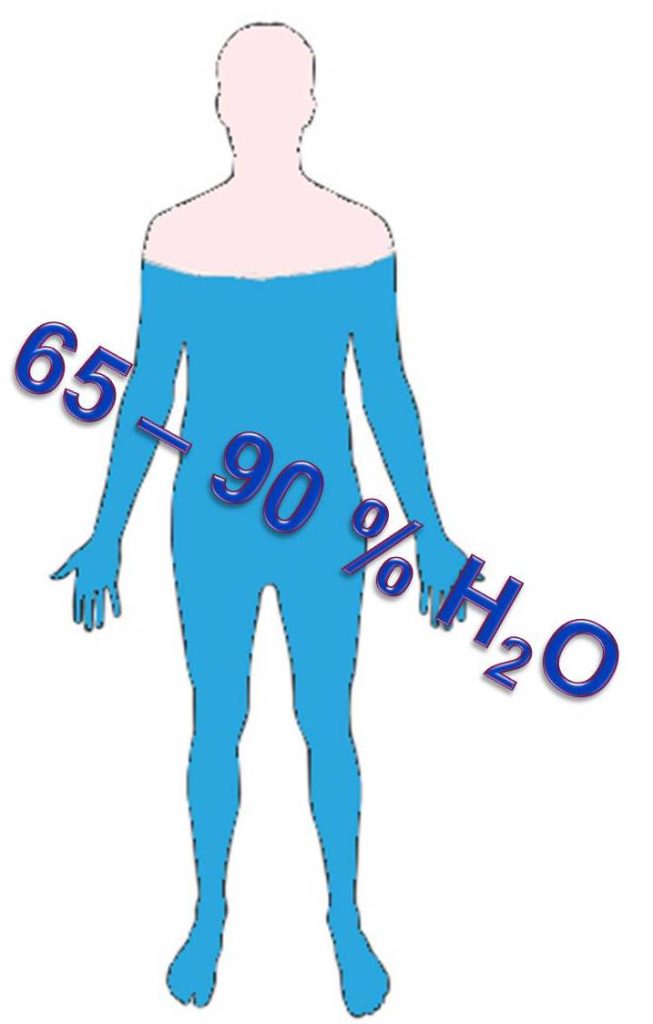 |
Oko 70% mase čoveka čini voda. U ćeliji čoveka voda zauzima između 65 i 90% mase. Udeo vode u drugim organizmima je različit, te čini od tek nekoliko procenata pa sve do 90% (na primer krv). Tako na primer različite ribe imaju oko 80 % vode u sebi. Zanimljivo je da meduze imaju više od 90% vode. Zrelo voće je puno tečnosti i ima uglavnom preko 80% vode. Takođe, i povrće sadrži veliku količinu vode (preko 90%). |
|
|
Da li čovek može opstati bez vode? |
||
|
Čovek ne može da preživi ukoliko izgubi 20% vode, za šta je potrebno 3—4 dana. Ako je hladnije, čovek može da preživi i duže, a ako je toplije, kad je na primer ljudsko telo izloženo sunčevoj svetlosti, vreme preživljavanja je kraće jer telo brže gubi tečnost putem znojenja. Za poređenje, bez hrane čovek može da živi više od tri nedelje (više od 20 dana). |
|
Koliko se molekul vode tokom 100 godina zadržava u okeanu, atmosferi i ledu? |
|
 |
Može se reći da u proseku, tokom perioda od 100 godina, molekul vode provede 98 godina u okeanu, 20 meseci u obliku leda, oko dve nedelje u jezerima i rekama, a manje od nedelju dana u atmosferi. Dakle, molekul vode se najduže zadržava u okeanu. |
 Flicka/Wikimedia Common (CC BY_SA 3.0) |
Isparavanje (evaporacija) vode je fizički proces kojim tečnost prelazi u vodenu paru. Dakle, evaporacija je proces prelaska iz tečnog agregatnog stanja u gasovito. Voda (tečnost) → vodena para (gas) Do isparavanja dolazi kada se tečnost zagreva. Toplota daje molekulima tečnosti više energije, čime se povećava pokretljivost molekula. Kada dobiju dovoljno energije, molekuli u blizini površine mogu da napuste površinu tečnosti |
|
|
Zašto je značajno isparavanje vode? |
|
|
Isparavanje omogućava da voda neprestano kruži u prirodi (više o tome u sledećem poglavlju). |
|
Da li postoji razlika između isparavanja i ključanja? |
|
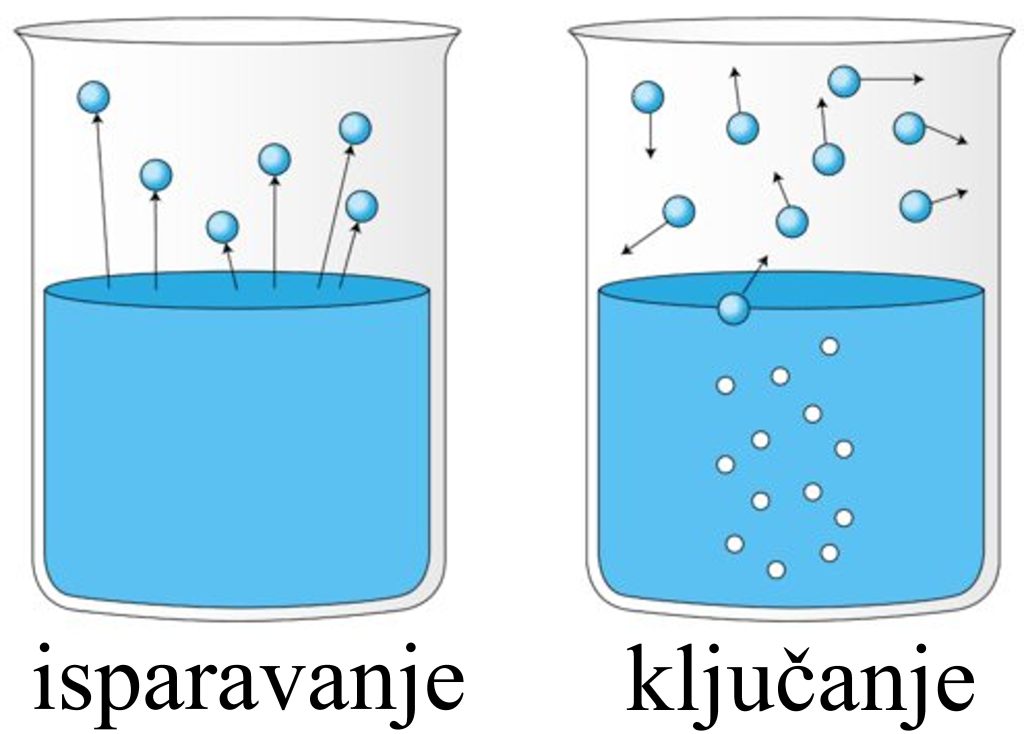 |
Tokom isparavanja, samo molekuli koji se nalaze u blizini površine tečnosti prelaze iz tečnog u gasovito stanje. Kod ključanja, voda takođe prelazi u gas, ali iz celokupne zapremine, a pri tome u tečnosti se stvaraju mehurići. Isparavanje se može odigrati na bilo kojoj temperaturi, a ključanje se dešava samo na određenoj temperaturi, koja se naziva tačka ključanja. |
|
Šta su glečeri? To su pokretne mase leda. Otprilike jedna desetina čitave površine Zemlje je pokrivena lednicima (glečerima), od toga ih se 99% nalazi u polarnim oblastima. Topljenje glečera se smatra najosetljivijim pokazateljem klimatskih promena i globalnog zagrevanja. |
| Sublimacija: |
|
Kondenzacija je fizički proces pretvaranja vodene pare (gasa) u tečnost (kapljevinu). Dakle, to je suprotan proces od isparavanja. vodena para (gas) → tečnost (kapljevina) Do kondenzacije dolazi kada se molekuli gasa ohlade. Pošto molekuli gasa gube toplotu (energiju), oni postaju sporiji, te ne mogu izbegavati privlačenje susednih molekula. Konačno, sakupljeni molekuli zajedno formiraju tečnost. 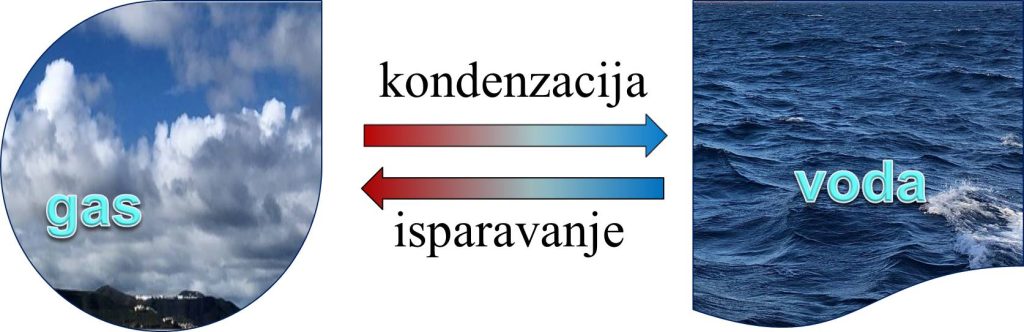 |
 Ángel Navarro/Unsplash (Unsplash License) |
Zbog čega je značajna kondenzacija? Kondenzacija ima veliki značaj pri kruženju vode, pošto je odgovorna za formiranje oblaka, koji nastaju kondenzovanjem vodene pare. |
 |
Transpiracija je isparavanje vodene pare sa površine biljaka, a naročito sa površina listova biljaka. Oko 10% vlage koja se nalazi u atmosferi oslobađaju biljke preko procesa transpiracije. Transpiracija omogućava razmenu gasova poput CO2 i vodene pare. |
|
Šta su padavine? |
||
 Fotografisali Mladen Franko i Mira Terzić |
Padavine nastaju iz oblaka. Mogu biti u obliku kiše, snega ili leda. Kiša je u tečnom agregatnom stanju dok su sneg i led u čvrstom. Padavine predstavljaju osnovi vid povratka vodene pare, vode i leda iz atmosfere na Zemlju. |
|
|
Još samo malo o agregatnim stanjima vode — o ponašanju molekula vode kada se zagrevaju i prolaze od čvrstog ka tečnom stanju, da bi na kraju prešli u gasovito: |
|
Koliku površinu Zemlje pokriva voda? |
|
|
Voda pokriva 71% Zemljine površine (okeani, mora, jezera, reke, potoci, bare i slično). Voda se nalazi i u unutrašnjost Zemlje, u vidu podzemnih voda. |
|
Da li na Zemlji postoji velik rezervoar slatke vode? |
|
 I, Luca Galuzzi/Wikimedia Commons (CC BY_SA 2.5) |
Da, postoji. Voda u glečerima je godinama zarobljena u obliku leda. Glečeri su velik rezervoar slatke vode (oko 75%). Najveći deo „zarobljene“ vode (oko 90%) nalazi se na Antarktiku. Ostatak ledene mase na planeti, oko 10%, nalazi se na Grenlandu. Međutim, glečeri se tope pod uticajem povećanja temperature zbog globalnog zagrevanja. |
|
Šta bi se dogodilo kada bi se otopili svi glečeri? Kada bi se otopili svi glečeri, nivo mora bi prema nekim procenama porastao za oko 70 m. Ovo bi imalo ogromne posledice na čitavu civilizaciju, a obalni gradovi bi bili potopljeni. |
|
Možete li zamisliti svet bez vode? |
|
 Kevin Gill from Nashua, NH, United States/Wikimedia Commons (CC BY-SA 2.0) |
 Cmglee/ Wikimedia Commons (CC BY-SA 4.0) |
|
Zar bi bilo života bez vode? |
|
|
Život kakav poznajemo počeo je u vodi. Čovek bez vode može da izdrži svega nedelju dana. Životinjama i biljkama je takođe potrebna voda da bi preživeli. Međutim, biljke mogu nešto duže preživeti bez vode u poređenju sa životinjama i čovekom. Setite se nekih vrsta kaktusa koji su izloženi ekstremnim uslovima, te su nekoliko mjeseci bez vode bez ikakvih problema. Takvo ponašanje kaktusa naziva se zimsko mirovanje. Dakle, nedostatak pitke vode na Zemlji dovešće do drastičnih promena u biljnom i životinjskom svetu, a moglo bi dovesti i do nestanka mnogih vrsti živog sveta. |
|
Zar ćemo nestati? Zaista? Evo primera: Zamislite zemljište, a da na njemu nema ničega — ništa ne raste, samo pesak, glina, stene. Zamislite vazduh bez vodene pare! Nema oblaka da zaštite zemlju od toplote Sunca, a vazduh je potpuno suv. |


