3 Metabolizem dušika – biokemijske pretvorbe
Tatjana Radovanović Vukajlović
Kaj potrebujejo kvasovke za rast?
Kvasovke so enocelični mikroorganizmi, naravno prisotni na kožicah grozdnih jagod. V odsotnosti kisika kvasovke sprožijo alkoholno vrenje oz. fermentacijo. V reakcijah alkoholnega vrenja kvasovke pretvorijoogljikove hidrate (sladkor) v ogljikov dioksid in etanol. V spontanih fermentacijah grozdnega soka ali drozgesodelujejo različne vrste in sevi naravno prisotnih kvasovk. Na splošno pa velja, da so sevi kvasovk Saccharomyces cerevisiae tolerantni na veliko koncentracijo etanola, zato proti koncu fermentacije največkrat te kvasovke prevzamejo dominantno vlogo.
Med fermentacijo se kvasovke seveda razvijajo in razmnožujejo, pri čemer za rast novih celic kvasovk potrebujejo kompleksna hranila, ki hkrati olajšajo potek same fermentacije. Ta hranila vkjlučujejo makroelemente, kot sta ogljik in dušik, minerale (npr. kalcij, magnezij, mangan, cink, fosfat in kalij), ter rastne dejavnike (vitamini, steroli in nenasičene maščobne kisline). Glavni vir ogljika in energije za rast kvasovk predstavljajo grozdni sladkorji, ki so običajno prisotni v velikem presežku (pogosto skupaj presegajo 20 % m/v) glede na količino potrebno za maksimalno rast. Vsebnost dušika (N) v grozdnem soku pa povprečno variira od 60 do 2400 mg/L (Amerine s sod., 1980; Ough, s sod., 1988) in je lahko omejujoč dejavnik rasti, če ga ni dovolj.
Potrebe kvasovk po dušiku in dušikovih spojinah v moštu in vinu
Za razmnoževanje potrebujejo kvasovke določene količine presnovljivega dušika, ki ga lahko uporabijo za izgradnjo celic. Koncentracija topnega dušika v moštu se giblje med 0,1 in 1 g/L (Henschke in Jiranek, 1993). Vsebnost dušikovih spojin v grozdnem soku pa je odvisna od: sorte grozdja, okužbe grozdja s sivo plesnijo Botrytis cinerea (te lahko porabijo hranila namenjena kvasovkam), časa trgatve, uporabe gnojil, dodatka hranil za kvasovke in bistrenja mošta pred fermentacijo. Razlike v količini in obliki dušika v grozdnem moštu vplivajo na rast celic, hitrost fermentacije in toleranco kvasovk na etanol (Zoecklein s sod., 1995).
Glavne dušikove spojine v grozdnem soku so: aminokisline (25–30 %), polipeptidi (25–40 %), amonijak (3–10 %) in beljakovine (5–10 %). V majhnih koncentracijah so prisotni tudi nitrati, amini in vitamini, dušikove baze (npr. adenin in uracil s koncentracijami od 4 do 15 mg/L in od 4 do 8 mg/L, ki jih kvasovke lahko vgradijo v svoje nukleinske kisline) (Monteiro in Bisson, 1992).
Asimilacijski dušik in njegova razpoložljivost v moštu in vinu
Kot vir dušika kvasovke lahko asimilirajo samo amonijev ion (ki je glavni vir dušika za rast kvasovk in se najlažje asimilira) ter aminokisline (razen prolina). Grozdne jagode za optimalen razvoj potrebujejo večjo količino dušikovih spojin. Privzem dušika poteka v dveh vrhovih: največji privzem je zaznan pri kabernikih (socvetju) od dveh tednov pred cvetenjem do štirih tednov po njem, ko se že oblikujejo grozdne jagode. Drugi vrh pa je prisoten ob začetku dozorevanja grozdja. Med procesom dozorevanja v grozdnih jagodah vsebnost amonijevega iona (NH₄⁺) upada, medtem ko se vsebnost organskega dušika povečuje (Verdenal s sod., 2020).
Večina dušika, prisotnega v grozdju je v obliki glutamina, ki se v grozdni jagodi pretvori v druge aminokisline s transaminacijo. Vsebnost dušika v grozdu pa je lahko zelo različna, in sicer glede na sorto, letnik, podlago, vinogradniško prakso, namakanje in gnojenje. Na primer, v grozdju iz trt, ki so bile izpostavljene pomanjkanju vode, lahko pričakujemo manjšo koncentracijo dušika. V nekaterih primerih je vsebnost naravno prisotnih virov dušika (amonija in aminokislin v moštu) razmeroma nizka, kar je lahko omejujoč dejavnik za fermentacijo, ter vodi do njenega upočasnjevanja ali zaustavitve. Zato v vinarstvu ta primanjkljaj mošta pogosto rešujemo z dodajanjem amonijevih soli, ki so poznane kot hrana za kvasovke. Kljub temu da dodana sol omogoča normalen in predvidljiv potek fermentacije, se ne dodaja vsepovprek in brez upoštevanja priporočil in informacije o dejanski založenosti mošta z dušikom. Preveliki odmerki namreč lahko povzročijo ostanek dušika v vinu, kar vodi do mikrobiološke nestabilnosti v vinu in nastanka strupenega etil karbamata (Suárez‐Lepe in Uthurry, 2007; Stevens in Ough, 1993).
Transport in asimilacija dušikovih spojin pri kvasovkah med fermentacijo
Celice kvasovk privzamejo amonijak in aminokisline iz mošta skozi celično membrano in jih prenesejo v citoplazmo kvasovk z mehanizmom, imenovanim aktivni transport (Slika 1). Aminokisline se sprva kopičijo v vakuolah, nato pa se porabijo za sintezo beljakovin. Kvasovke potrebujejo dušik za sintezo novih beljakovin (in tudi drugih molekul), kot so encimi glikolize (ki omogočajo biokonverzijo glukoze in fruktoze v etanol) ali permeaze, ki se nahajajo v celični membrani kvasovk in so odgovorne za transport aminokislin in sladkorjev v celice kvasovk. Beljakovine se porabijo tudi za izgradnjo celičnih struktur pri nastanku novih kvasnih celic. Učinkovita sinteza beljakovin kvasovk je klučna za učinkovit transport sladkorja in potek celotnega metabolizma kvasovk. Razpoložljivost dušikovih spojin neposredno spodbuja sintezo beljakovin, zato vsak dejavnik, ki vpliva na znotrajcelično raven dušika, neposredno vpliva tudi na metabolizem kvasovk.
Aminokisline potujejo torej iz mošta v celico z aktivnim transportom. Pri aktivnem transportu aminokislin, ki za nastanek ATP‐ja (iz angl. adenosine triphosphate, ATP) zahteva prisotnost glukoze, se v isto smer prenaša tudi vodikov ion (H+) (Cooper, 1982) (Slika 1, Slika 2). Ta oblika transporta se imenuje simport. Koncentracija vodikovih ionov v danem mediju je povezana s vrednostjo pH medija. Grozdni mošt ima običajno vrednost pH med 3 in 4, notranjost celice kvasovk pa med 6 in 7, kar pomeni, da je koncentracija ionov H+ zunaj večja kot znotraj. Za optimalno delovanje kvasovk med fermentacijo mora kvasovka v citoplazmi vzdrževati stabilno vrednost pH. Med fermentacijo, ko se koncentracija etanola povečuje, postaja celična membrana kvasovk postopoma vse bolj prepustna za ione H+, kar posledično pomeni večjo pasivno difuzijo vodikovih ionov v celico kvasovk. Kvasovka nima nadzora nad tem spontanim dotokom ionov H+ v citoplazmo, vendar lahko nadzoruje vnos ionov H+, ki vstopajo v celico med absorpcijo aminokislin. Z energijskega vidika je vzdrževanje stabilne vrednost pH v citoplazmi celice zelo potratno. V zgodnji fazi fermentacije kvasovke absorbirajo aminokisline skupaj s spremljajočimi ioni H+ in jih nato izločijo nazaj v mošt preko poti, ki potrebuje vključitev energijsko bogatih molekul ATP‐ja (encimi ATP‐aze, glejte Sliko 2). Posledično kvasovke takrat ustavijo privzem aminokislin, da tako prihranijo energijo in ohranijo stabilno notranjo vrednost pH. Učinek tega na absorpcijo aminokislin je, da ko kvasovke inokuliramo v mošt, začnejo nemudoma privzemati (asimilirati) ves raspoložljivi dušik. Dušikove spojine se tako najbolj asimilirajo v prvih nekaj urah fermentacije, v zgodnjih fazah, tj. prvih 20–30 g/L fermentiranega sladkorja. Potem se asimilacija aminokislin ustavi, da se prepreči vnos protonov v celico in posledično znižanje vrednosti pH.
Od vseh virov dušika se prav amonijevi ioni najhitreje absorbirajo, zato jih je najenostavneje uporabiti. Dušik v obliki amonijevih ionov (NH4+) hitro vstopa v biosintezno pot aminokislin z aktivnostjo encima nikotinamid adenin dinukleotid fosfat (NADP+) glutamat dehidrogenaze (NADP‐GDH). Po drugi strani je amonijak končni produkt razgradnje dušikovih spojin v reakciji, ki jo katalizira od nikotinamid adenin dinukleotida (NAD+) odvisna glutamat dehidrogenaza (NAD‐GDH). Aminokisline so podvržene reakciji transaminacije, v kateri ima glutamat ključno vlogo kot donor in akceptor amino skupin (Carrascosa s sod., 2011). Amonijev ion (NH4+) (Slika 1) se v kvasno celico prav tako prenaša z aktivnim transportom kot aminokisline, vendar absorpcija poteka dlje časa kot pri aminokislinah in se torej ustavi pozneje med fermentacijo.
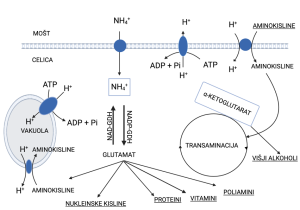
Slika 1. Shematski prikaz privzema in metabolizma dušikovih spojin v celici kvasovke (prirejeno po Carrascosu s sod., 2011 ter Llauradó, 2002)
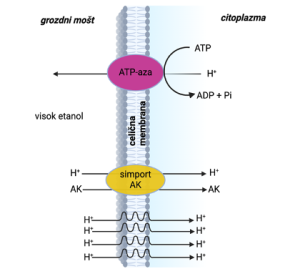
Slika 2. Transport aminokislin in učinek prisotnosti etanola na pasivni pretok protonov (prirejeno po Boultonu s sod., 1996).
Aminokisline prisotne v moštu
V grozdnem moštu najdemo različne aminokisline. Prevladujoči sta prolin in arginin, kadar je mošt pridelan iz grozdja vinogradov, v katerih se je uporabilo malo gnojil. Amerine s sod. (1980) poroča, da koncentracija aminokislin v moštu variira med 65 in 1130 mg/L, odvisno od sorte, regije, časa trgatve, količine dušika v zemlji in gnojenja (Bell s sod., 1979). Arginin je večinoma v kožicah grozdja; postopki predelave grozdja, ki vključujejo drozganje in stiskanje, v primerjavi s stiskanjem celega grozda lahko vplivajo na povečanje vsebnost arginina v grozdnem soku. Študija, ki jo je objavil Petrovic s sod., (2019), je pokazala, da sta prolin in arginin najbolj zastopani aminokislini v grozdnem moštu s povprečno koncentracijo 697,7 mg/L in 388,3 mg/L, le da prolin lahko doseže koncentracijo tudi do 4000 mg/L (Bell in Henscke, 2005). Med bolje zastopanimi aminokislinami so tudi glutamat, alanin, serin in treonin. Z dodatkom gnojil trtam lahko glutamin postane glavna aminokislina v grozdju. Na splošno kvasovke najprej prevzamejo glutamat in amonijeve ione, ki imajo ključno vlogo v metabolizmu dušika pri kvasovkah, kot je razvidno iz Slike 3. Glutamin je pri kvasovkah pomemben, ker se lahko razgradi na glutamat in amonijak (Godard s sod., 2007; Jiranek s sod., 1995). Nasprotno pa so najmanjše izmerjene koncentracije glicina (3,2 mg/L), metionina (3,6 mg/L) in lizina (3,9 mg/L) (Petrovic s sod., 2019).
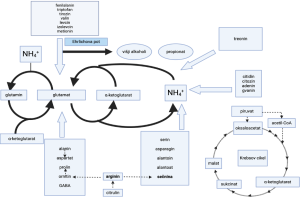
Slika 3. Metabolizem dušika pri kvasovkah (prirejeno po Godardu s sod., 2007)
Absorpcija aminokislin je v veliki meri odvisna od relativnih koncentracij aminokislin v moštu. Kvasovke prevzamejo aminokisline in jih večinoma skladiščijo v vakuolah (Slika 1) ter jih v kasnejših fazah rasti uporabijo za sintezo beljakovin (Jiranek s sod., 1995). Ko anorganski dušik (v obliki amonijevih ionov) ni več dostopen oziroma se porabi, kvasovke začnejo razgrajevati shranjene aminokisline kot vir dušika za biosintezo. Na koncentracije aminokislin v grozdnem moštu zelo vplivajo vinogradniške prakse in klimatske razmere. Velike koncentracije prolina so povezane s pomanjkanjem vode (vodnim/sušnim stresom) pri vinski trti, kar pa na dostopnost dušika ne vpliva, ker ga kvasovke ne morejo izkoriščati kot vir amonijaka v aerobnih razmerah. Najbolj dostopna aminokislina za kvasovke v grozdju ob trgatvi je arginin. Kljub visoki vsebnosti arginina kvasovke najprej porabljajo amonijak in glutamat kot vir dušika. Arginin je pomemben vir dušika za kvasovke, vendar je njegovo kopičenje v njih odvisno od prisotnosti drugih prednostnih virov dušika, kot je amonijev ion (Henscke in Jiranek, 1993; Jiranek s sod., 1995). Dodatek diamonijevega fosfata – DAP (diamonijev hidrogen fosfat (NH4)2HPO4) torej zavira uporabo arginina, dokler se amonij ne porabi. Arginin v reakciji z encimom arginazo pripelje do tvorbe ornitina in sečnine. Ti dve spojini pod določenimi pogoji tvorita glutamat in amonijev ion, ki sta prekurzorja biosinteze aminokislin v kvasovkah (Large, 1986) (Slika 4) na eni strani, ali karbamoil fosfat na drugi. Sečnina pa se lahko, odvisno od seva kvasovk, izloči v mošt, tako da se s tem tudi uravna količina dušika v kvasnih celicah. Prisotnost sečnine v vinu ni problematična, vendar lahko med staranjem vina reagira z etanolom in tvori potencialno rakotvoren etil karbamat (Stevens in Ough, 1993; Mirvish s sod., 1994). Količine etil karbamata v vinu so v nekaterih državah nadzorovane tudi z zakonodajo, medtem ko za Slovenijo ni podatka, da bi bila količina etil karbamata v vinu zakonsko nadzorovana, jo pa lahko določimo npr. v laboratorijih Kmetijskega inštituta Slovenije.
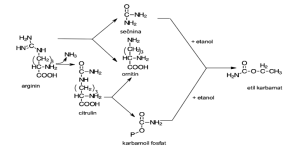
Slika 4. Nastanek etil karbamata iz citrulina ali sečnine (prirejeno od Ribéreau-Gayon, 2000)
Če so dostopne zadostne količine asimilacijskega dušika v obliki amonijaka, glutamata in glutamina, se razgradnja arginina zmanjšuje in s tem tudi tvorba etil karbamata (Mirvish s sod., 1994; Stevens in Ough, 1993; Suárez‐Lepe in Uthurry, 2007).
Kvasovke lahko aminokisline neposredno porabijo za sintezo beljakovin. Koncentracije posameznih razpoložljivih aminokislin niso vedno v skladu s trenutnimi potrebami celice, lahko pride do pomanjkanja ali presežka omenjenih aminokislin. Kvasovke pa lahko, presežne aminokisline pretvorijo v tiste, ki jih trenutno potrebujejo. Ob pomanjkanju amonijevih soli lahko kvasovke začnejo presnavljati tudi aminokisline, ki vsebujejo žveplo, kot sta cistein in metionin. Kot produkt nastaja vodikov sulfid (H2S) in v nadaljnjih stopnjah fermentacije, ob neukrepanju kletarja, tudi merkaptani (Vos s sod., 1978; Vos in Gray, 1979), ki pa na kakovost vina vplivajo negativno zaradi neprijetnega vonja. Pri odpravljanju tovrstnih napak vina je pomemben ukrep dodatek amonijevih soli.
Metode za določanje koncentracije asimilacijskega dušika za kvasovke
Da bi lahko dodali primerno količino dušikovih hranil, je treba zaradi sezonske variabilnosti založenost z dušikom tudi meriti. Pomemben vir kvasovkam dostopnega dušika v grozdju in moštu so amonijeve soli (NH4+) ter aminokisline z dostopnim dušikom, poznane pod skupnim imenom oziroma kratico YAN (iz angl. yeast assimilable nitrogen, slov. asimilacijski dušik za kvasovke). Ti viri dušika so poleg sladkorja najpomembnejši vir hranil za optimalno delovanje kvasovk med fermentacijo mošta v vino. YAN predstavlja seštevek dušika anorganskega in organskega izvora. Amonijevi ioni predstavljajo anorganski vir, prosti aminokislinski dušik (angl. free amino nitrogen, FAN), proste α‐aminokisline in majhni peptidi pa organski vir dušika (enačba 1.).
YAN = dušik iz amonijevih ionov + α-aminokislinski dušik (1)
Za izračun YAN-a moramo sešteti tako koncentracijo amonijevih ionov kot FAN, oboje pa izraziti v ekvivalentih dušika v mg/L kot je predstavljeno v enačbi 2.
YAN = 0,824 × koncentracija amonijevih ionov + FAN (2)
Faktor 0,824 pretvori koncentracijo amonijaka v ekvivalente dušika.
Za določitev vrednosti YAN se izmeri FAN, ki vključuje tako α‐amino kisline kot tudi majhne peptide (1-3-aminokislinski ostanki). Oba vira (amonijeve ione kot tudi FAN) kvasovka potrebuje za razvoj in metabolizem. Celokupni dušik v moštu tako poleg YAN zajema tudi peptide in proteine, ki nimajo pomembne vloge v prehrani kvasovk med fermentacijo. Priporočene minimalne koncentracije YAN-a za popolno alkoholno fermentacijo znašajo med 140 in 160 mg/L (Bell in Henschke, 2005).
Oba vira dušika se lahko določita v moštu z ločenimi analiznimi metodami. Analizo amonijaka lahko izvedemo z encimskim diagnostičnim kompletom (včasih ga poznamo tudi kot encimski kit) in UV/VIS spektrofotometrom (obstajajo različni komercialno dostopni kompleti), ali pa z uporabo posebne ionoselektivne elektrode, ki je občutljiva za amonijeve ione in jo lahko pritrdimo na večino merilnikov vrednosti pH.
Za analizo aminokislinskega dušika v grozdnem moštu poznamo več načinov:
- Formolna titracija– je postopek titracije aminokislin s kalijevim hidroksidom v prisotnosti formaldehida. Uporablja se za določanje vsebnosti posameznih aminokislin kot tudi proteinov v različnih vzorcih (Sørensen, 1907)
- NOPA (angl. nitrogen by o-phthalaldehyde) spektrofotometrična metoda (določanje aminokislinskega dušika z reagentom o-ftalaldehid/N-acetil-L-cistein pri valovni dolžini 335 nm) in tudi različni encimski testi (Dukes in Butzke, 1998; Iland s sod., 2021; Weeks in Henscke, 2007).
- Tekočinska kromatografija visoke ločljivosti (HPLC, iz angl. – High Pressure Liquid Chromatography) v kombinaciji s flourescenčnim (FLD) ali ultravijoličnim (UV) detektorjem. Vzorci zahtevajo derivatizacijo aminokislin z o-ftaladehidom, z metodo pa določamo posamezne aminokisline (Cooper s sod., 1984; Iland s sod., 2021; Sørensen s sod., 1999).
- Spektroskopija v bližnjem infrardečem predelu (NIR- iz angl. Near Infra-Red Spectroscopy) (Cozzolino s sod., 2006).
Vsebnosti virov dušika lahko zelo variirajo glede na letnik, sorto in vinograd, zato poploševanje ni primerno, še posebno če podatki o določeni sorti temeljijo na raziskavah iz drugih državah ali na drugačnih metodah (določeni encimski kompleti lahko dajo nekoliko drugačne rezultate). Illand s sod. (2021) pravi, da koncentracija YAN‐a lahko variira od 130 do 240 mg/L, prav tako lahko med sortami variira tudi razmerje med anorganskim in organskim virom dušika, in to vedno v korist organskega. Glede na avtorja Bell in Henschke (2005) je priporočljiva vsebnost dušika za uspešno fermentacijo med 140 in 150 mg/L.
Vrednost YAN‐a v moštu je od 50 do 450 mg/L, s povprečno vrednostjo približno 200 mg/L. Najnižja vrednost YAN‐a, potrebna za normalen potek fermentacije, je 140–150 mg/L za bistri mošt z vsebnostjo sladkorjev 21 Brixovih stopinj. Skupna potreba po dušiku med fermentacijo je odvisna od uporabljenega seva kvasovk, začetne koncentracije sladkorja in specifičnih pogojev fermentacije. Nekateri sevi kvasovk imajo večjo potrebo po dušiku kot drugi, zato je pomembno poznati karakteristike uporabljenega seva in seveda spremljati začetno založenost z asimilacijskim dušikom v moštu. Sevi kvasovk z manjšo potrebo po dušiku morda dejansko ne potrebujejo dodatnega dodajanja dušika ali dušikovih spojin. Na vrednost YAN‐a vpliva tudi prisotnost kisika, ki je kvasovkam potreben za sintezo sterola in nenasičenih maščobnih kislin. Te spojine omogočajo rast in popolno fermentacijo sladkorjev v moštu, ter jim pomagajo, da preživijo velike koncentracije alkohola na koncu fermentacije. Temperatura prav tako vpliva na koncentracijo YAN‐a, saj imajo pri višji temperaturi fermentacije kvasovke večjo potrebo po dušiku. Vrednost YAN je treba obravnavati kot indikativno, da bi se zadovoljile minimalne potrebe po dušiku in preprečile resne težave (O’Kennedy in Reid, 2008) med fermentacijo.
Pri premajhni koncentraciji YAN‐a lahko med fermentacijo pričakujemo povečano koncentracijo H2S (vodikov sulfid) in drugih neželenih hlapnih spojin, ki vsebujejo žveplo. Manjše koncentracije dušika omejujejo nastanek prekurzorjev aminokislin z žveplom, kot sta metionin in cistein, ki jih kvasovke sintetizirajo med fermentacijo. Posledično se sulfid, ki nastane iz sulfata in sulfitnih ionov, za vgradnjo v te prekurzorje, nakopiči in difundira iz celice v mošt. Večina vinarjev rešuje pomanjkanje dušika z dodajanjem diamonijevih soli (diamonijev fosfat – DAP) in/ali hranil, ki vsebujejo dušik (kot so aminokisline in peptidi) že kar v mošt. Meritve koncentracije YAN v moštu povedo vinarju, koliko teh dodatkov je potrebno za uspešen potek fermentacije.
Zadostna koncentracija YAN‐a preprečuje nastanek H2S ali drugih neželenih žveplastih spojin in upočasnitev fermentacije ter omogoča nastanek želenih arom. Merjenje vrednosti YAN zagotavlja informacijo o založenosti z dušikom v moštu, ne pa informacije o drugih potrebnih hranilih. Te hranilne snovi je potrebno dodajati, najbolje na podlagi priporočil proizvajalcev kvasovk.
Pri preveliki koncentraciji YAN-a (večji od 150 mg/L), lahko po dodatku DAP‐a včasih nastanejo H2S ali druge žveplove spojine. Posledično fermentacija poteka preveč burno, kar lahko negativno vpliva na sam proces. Pri rdečih moštih lahko prevelika koncentracija YAN-a povzroči nastanek tiolov, kar ni skladno s želenim aromatskim profilom vina. Prevelika koncentracija YAN‐a prav tako spodbuja rast neželenih mikroorganizmov.
Med letniki vsebnost YAN‐a v moštih lahko znatno variira, zato ga je priporočljivo pred vsako trgatvijo določati. Pri tem imajo pomembno vlogo tudi izkušnje vinogradnika oziroma vinarja, ki lahko na podlagi poznavanja posameznih vinogradov in značilnosti mošta predvidi, katero grozdje ali mošt bi lahko imelo težave z nezadostno založenostjo z dušikom. V tem primeru je vinar praviloma pozornejši, na način, da kakovost mošta dodatno spremlja z analizami, kar omogoča boljše upravljanje fermentacijskih procesov (Iland s sod., 2021).
Oblike dodajanja dušika v grozdni mošt
Dodajanje dušika v grozdni mošt je že dobro uveljavljena praksa. Najpogosteje se dušik dodaja v obliki DAP-a, ki zagotavlja lahko dostopen vir dušika in je bistven za presnovo in rast kvasovk. DAP vsebuje 21,54% (m/m) dušika glede na izračunan masni delež. Če želimo povečati YAN iz začetnih 100 mg/L YAN-a na priporočeno vrednost 150 mg/L, je treba moštu dodati 45 g DAP/hL (450 mg/L). Pri dodajanju dušika v obliki DAP je v nekaterih državah veljajo zakonske omejitve glede dovoljene količine diamonijevega fosfata v vinu, ki jih morajo vinarji upoštevati. Amonijev ion prisoten v diamonijevem fosfatu (DAP-u) se lahko vgradi v celice kvasovk, ki ga nato uporabljajo za svoj metabolizem. V Evropski Uniji je dovoljen dodatek od 30 gDAP/hL mošta (300 mg (NH4)2HPO4/L). Dodatek 100 mg DAP-a prispeva približno 22 % vsebnosti dušika – kar pomeni povečanje YAN-a za 22 mg/L -a (O’Kennedy in Reid, 2008). DAP lahko spodbudi rast kvasovk in aktivnost fermentacije, prispeva k sortnosti in ščiti pred nastankom vodikovega sulfida in drugih neželjenih arom. DAP dodajamo enkratno ali pa postopoma v korakih, pri čemer količino vedno določimo na podlagi začetne koncentracije YAN-a v moštu. DAP lahko dodajamo tudi med fermentacijo,v količinah med 100 do 300 mg/L. Običajno jih dodamo po prvi tretjini pretečene fermentacije ali če opazimo zastoj fermentacije, vendar ne kasneje od 60 % pretečene fermentacije. Dodatek DAP-a je priporočljiv tudi, ko med fermentacijo zaznavamo vodikov sulfid in je koncentracija YAN manjša od 100 mg/L. Odsvetuje se, da čakamo na zelo upočasnjeno fermentacijo, saj je v tem primeru učinkovitost dodatka DAP‐a zelo omejena.
Sečnina, ki se je včasih tudi uporabljala kot dodaten vir dušika, danes večinoma ni več dovoljena, saj lahko njena uporaba vodi do nastanka potencialno karcinogenega etil karbamata (Mirvish s sod., 1994). Z alternativnimi viri dušika, kot so na primer tekoči amonijak (ni dovoljen v nekaterih državah) ali soli amonijevega sulfata, se lahko izognemo presežku fosfata. V Južni Afriki je uporaba tekočega amonijaka, primernega za živila, prav tako dovoljen dodatek dušika med fermentacijo. Raztopina amonijaka, ki se uporablja v industriji, ima 25‐odstotno vsebnost dušika, tako da je dodatek najmanj 40 mL/hL te raztopine enakovreden 100 mg/L YAN‐a. Prednost uporabe tekočega amonijaka je, da s tem ne dodajamo fosfatov, zato se lahko po potrebi uporabijo veliko večji odmerki. Nekateri vinarji poleg DAP‐a uporabljajo še hranila, ki vsebujejo aminokisline, minerale, vitamine in/ali druge sestavine, pomembne za rast kvasovk (Iland s sod., 2021). Med alternativnimi viri dušika se uporabljajo tudi inaktivirane kvasovke ali kvasni avtolizati, ki se dodajajo poleg DAP‐a (Iland s sod., 2021). Pri uporabi teh hranilnih dodatkov je nujno upoštevati navodila proizvajalcev in zakonodajo – pri čemer ne smemo pozabiti niti na potencialni izvoz vina v države z morda drugačno zakonodajo od države pridelovalke.
V praksi je pomembno, da vinarji na začetku fermentacije omogočijo kvasovkam, da privzamejo naravno prisotne aminokisline, saj proizvedeni etanol kasneje zavira absorpcijo aminokislin. Dejavnika, ki lahko negativno vplivata na zgodnji privzem aminokislin, sta presežena koncentracija dodanega anorganskega dušika (npr. DAP‐a) v mošt, in bistrenje mošta z bentonitom (sredstvo za bistrenje mošta/vina) v zgodnjih fazah fermentacije. Amonijevi ioni so za kvasovke zaželen vir dušika, saj jih lahko absorbirajo lažje kot aminokisline, ki zahtevajo dodatne reakcije za sproščanje dušika. Zgodnje dodajanje amonijevih ionov spodbuja rast kvasovk in tako povečuje potrebo po dušiku pozneje med fermentacijo. Čezmerna uporaba DAP‐a lahko pripelje do zakisanosti vina, ker kvasovke privzamejo spremljajoče vodikove ione, nato pa se izločajo v medij, da ohranijo celično citoplazmo pri nevtralnem pH‐ju (O’Kennedy in Reid, 2008).
Bentonit veže beljakovine in aminokisline precej nespecifično. Dodatek bentonita v začetnih fazah pridelave vina lahko odstrani aminokisline, ki so ključne za delovanje kvasnih celic. Nekatere aminokisline so tudi pomembni prekurzorji arom, tako da se z njihovo odstranitvijo iz soka lahko odstranijo arome vina in zmanjša kakovost vina. Zato je priporočljivo stabilizirati beljakovine med fermentacijo šele, ko kvasovke absorbirajo največjo količino aminokislin (O’Kennedy in Reid, 2008).
Kdaj je treba dodati DAP?
Kot je že omenjeno zgoraj DAP se lahko doda kot enkraten odmerek ali večkrat med fermentacijo. Če se DAP doda na začetku fermentacije, lahko povzroča zmanjšan vnos aminokislinskega (ali malih peptidov) dušika. Dodatek amonijevih ionov zgodaj med fermentacijo bo delno zaviral privzem dušika aminokislin, saj je amonijev ion eden najenostavnejših virov dušika za kvasovke. Poleg tega presežek dušika na začetku fermentacije spodbuja rast in razmnoževanje kvasovk ter tako povečuje potrebo po dušiku pozneje med fermentacijo. Povečana je tudi presnova kvasovk in ustvarjanje toplote, ki se sprošča med reakcijo alkoholne fermentacije. Če dodatek dušikovih hranil ni nadzorovan, je možen nenaden porast temperature, znan kot vročinski vrh, ki lahko povzroči poškodbe kvasovk in s tem zmanjša njihovo sposobnost preživetja, zlasti proti koncu fermentacije. Večina moštov naravno vsebuje zadostno količino dušika za začetek fermentacije, razen če je grozdje okuženo s plesnijo.
V praksi se najpogosteje dodaja kar pri inokulaciji kvasovk, kar pa lahko spodbudi rast ne‐ Saccharomyceskvasovk. Nekateri strokovnjaki predlagajo dodajanje DAP-a 48 in 72 ur po inokulaciji kvasovk v eksponencialni fazi rasti (v prvi tretjini fermentacije ali pri proizvodnji H2S) (Mendes‐Fereira s sod., 2010; Thomas s sod., 1993). Vos s sod. (1978) ter Sablayrolles s sod., (1996) so pokazali, da je enkraten odmerek, dodan sredi fermentacije, enako učinkovit kot enkraten odmerek na začetku fermentacije. Beltran s sod. (2005) je ugotovil, da je dodatek amonijaka pozno v fermentaciji nezaželen, ker kvasovke Sacharomyces v tej fazi ne porabljajo anorganskega dušika. Čezmerna količina amonijaka v vinu pa lahko spodbuja rast kvarljivih mikroorganizmov po končani fermentaciji.
Količina in čas dodajanja DAP‐a grozdnemu moštu lahko vpliva na presnovo aminokislin. Ko se koncentracija amonijaka zmanjša, se shranjene aminokisline presnovijo, kar lahko vodi v slabšo kakovost vina. Pomanjkanje amonijaka lahko povzroči ne le nastanek H2S, ampak tudi sečnine ali večjih koncentracij višjih alkoholov (glejte Sliko 4). Preprečevanje tvorbe H2S ni edini namen dodajanja dušika. H2S lahko vedno odstranimo bodisi s pretokom in zračenjem bodisi z enološkimi čistili, ne moremo pa odstraniti nastale sečnine in višjih alkoholov. Med fermentacijo je treba dodati amonijak v pravih koncentracijah ob pravem času, da se omogoči optimalen vnos aminokislin in amonijaka v celice kvasovk. Upoštevati je treba začetno vrednost YAN‐a v grozdnem moštu, metabolizem kvasovk in izbrano vrsto kvasovk. Vsako fermentacijo je treba obravnavati ločeno, ne moremo posploševati, saj ima grozdni sok (mošt) drugačno sestavo, različni pa so tudi drugi pogoji fermentacije. Upravljanje vsebnosti dušika je torej pomemben dejavnik pri pridelavi kakovostnega vina (Ugliano s sod., 2007). Raziskave, ki so jih objavili Vos s sod. (1978) ter Vos in Gray (1979), so pokazale, da dodatek DAP‐a v mošt ni pomemben samo pri zagotavljanju optimalne učinkovitosti fermentacije, ampak pomembno vpliva tudi na profil arome in okusa vin. Če se fermentacija zaključi z majhno količino proizvedenega H2S ali brez njega, to ne pomeni, da je bila uspešna z vidika arome in okusa vina.
Pomembno si je tudi zapomniti, da zvišanje temperature fermentacije poveča potrebo po dušiku, saj se pri višji temperaturi spodbuja rast kvasovk, fermentacija je hitrejša in torej večja poraba dušikovih spojin v izgradnji novih celic. Če je dodatek dušika v moštu neustrezen, je tudi potencialno nastajanje H2S v moštu večje pri višjih temperaturah. Absorpcija dušika v kvasovke je odvisna z razpoložljivostji kisika v moštu/drozgi. Dodajanje kisika moštu (npr. s prečrpavanjem), lahko pospeši absorpcijo dušika, za razliko od fermentacij, ki potekajo v anaerobnih pogojih. Večje ko so začetne koncentracije grozdnega sladkorja, večje bodo potrebe po dušiku. Kljub temu dodajanje prevelikih količin amonijaka med fermentacijo ni priporočljivo. Čezmerni dodatki amonijaka lahko povzročijo prisotnost neasimiliranega amonijaka na koncu fermentacije. To lahko vpliva na mikrobno stabilnost vina. Mlečnokislinske bakterije ne morejo asimilirati amonijaka, lahko pa to storijo različni mikroorganizmi, ki povzročajo kvarjenje, npr. Brettanomyces. Prevelik dodatek DAP‐a lahko vinu daje slan okus ter povzroči nastajanje etil acetata in včasih sulfidov (zaradi neravnovesja v razmerju pantotenske kisline in YAN‐a). Nezadostne koncentracije dušika lahko povzročijo redukcijske arome v vinu, pa tudi prevelike koncentracije neprijetno dišečih višjih alkoholov in majhne koncentracije prijetno dišečih estrov. Preveč dodatkov lahko spodbudi proizvodnjo etil acetata in jantarne kisline v kvasovkah. Če so prisotni v preveliki koncentraciji, lahko negativno vplivajo na organoleptiko vina. Zmerni dodatki torej zagotavljajo optimalno ravnovesje prijetnih dišečih estrov in višjih alkoholov ter odsotnost negativnih arom, povezanih s previsokim ali prenizkim YAN‐om. Iz tega je razvidno, da je treba strogo nadzorovati dodajanje dušika med fermentacijo in da standardno dodajanje DAP‐a (npr. 30 g/hL) ali enkraten dodatek samo na podlagi vrednosti YAN ne bo zadovoljiva rešitev (Vos s sod., 1978; Vos, 1993).
Povezava med pomanjkanjem dušika in nastajanjem neprijetnega vonja po žveplu
Obstaja obratno sorazmerje med pomanjkanjem dušika in nastajanjem vodikovega sulfida, tj. manj ko je dušika, ki ga kvasovke lahko asimilirajo, več bo nastalo vodikovega sulfida (kar je že objavljeno v študiji Jiranek in Henschke, 1991). V najslabšem primeru pomanjkanje asimilacijskega dušika lahko ustavi fermentacijo. To se zgodi, ker je razpolovna doba beljakovin (v citoplazemski membrani), ki transportirajo sladkorje v celice kvasovk, približno šest ur in se redno razgrajujejo, zato je za sintezo novih transportnih beljakovin potreben asimilacijski dušik. Če za sintezo aminokislin in kasnejšo sintezo beljakovin nimamo asimilacijskega dušika, transportnih beljakovin ni mogoče proizvesti in sladkorja ni mogoče transportirati v kvasno celico. Vendar pa se transport sladkorja v kvasno celico popolnoma zaustavi šele 50 ur po popolni porabi dušika. Pri pomanjkanju dušika za kvasovke med fermentacijo večinoma nastane žveplu podoben neprijeten vonj, kot so na primer vodikov sulfid, merkaptani in acetatni estri, ki vsebujejo žveplo (Jiranek in Henscke, 1991). Te spojine začnejo nastajati 30 minut po porabi amonijaka. Vodikov sulfid in merkaptane iz pokvarjenih vin učinkovito odstranijo prečrpavanja in tretmaji z bakrom, vendar acetatni estri, ki vsebujejo žveplo, ostanejo v končnih vinih, kjer sčasoma hidrolizirajo v vodikov sulfid in merkaptane; to pa pomeni težavo v že stekleničenem vinu.
Vzroki za nastanek neprijetnih vonjav v moštu in vinu
V kolikor fermentacija poteka brez težav, je najpomembnejši vir proizvodnje vodikovega sulfida redukcija sulfata po sulfat reducirajoči poti. Kvasovke uporabljajo proizvedeni vodikov sulfid za biosintezo aminokislin, ki vsebujejo žveplo (metionin in cistein). V odsotnosti znotrajceličnih virov dušika se proces redukcije sulfata ali sulfita nadaljuje, pri čemer nastane presežek H2S, ki ga ni mogoče vgraditi v aminokisline in se nato izloči v medij – to je fermentirajoči mošt. To nam pomaga razumeti, zakaj pravočasen dodatek dušika pomaga odpraviti vonj po H₂S v fermentiranem moštu, če ga zaznamo dovolj zgodaj. Zgodnje nastajanje majhnih količin H2S v moštu ni nujno problem za kakovost vina, saj lahko kvasovke še vedno prevzamejo dodan dušik in ga porabijo za sintezo aminokislin. Ogljikov dioksid (CO2), ki je nastal med fermentacijo in izhaja v prostor, pa lahko pomaga pri odstranjevanju H2S iz mošta. Za kakovost vina je bistvena količina vonjev, podobnih žveplu, ki ostanejo na koncu fermentacije zaradi pozne porabe dušika in kvasovk, ki niso učinkoviti pri sprejemanju dodanega dušika in proizvajanju zadostne količine CO2 (Jiranek in Henscke, 1991).
Velike količine žveplovega dioksida (SO2) (več kot 80 ppm), ki se dodajajo pri pecljanju in drozganju mošta, lahko pospešijo nastanek žveplu podobnih vonjev, saj žveplovemu dioksidu omogočijo, da vstopi neposredno v celico kvasovk, tako da se izogne sulfat reducirajoči poti. Vendar pa tako veliki dodatki v začetnih fazah pridelave vina niso običajna praksa, saj lahko inhibirajo metabolizem kvasovk.
Na nastanek neprijetnega vonja po žveplu lahko vpliva tudi motnost mošta/vina, ki jo izražamo v enotah NTU (angl. Nephelometric Turbidity Unit). Motnost se, v odvisnosti od tipa pridelanega vina, giblje med 50 in 250 NTU. Načeloma velja, da manjša kot je motnost mošta, bolj izražena je kasneje aromatika pridelanega vina. Če je NTU prenizek (manjša motnost mošta), je mošt verjetno osiromašen s hranilnimi snovmi, kar ima za posledico nizek YAN in lahko povzroči neprijeten vonj po žveplu. Previsoka motnost pa po drugi strani lahko povzroči nastanek neželenih arom po žveplu (Zoecklein, 2008).
Postopki pridelave vina, kot je npr. hladna maceracija, lahko pospešijo rast ne‐Saccharomyces kvasovk (npr. Kloeckera spp). Ta rast lahko povzroči porabo naravno prisotnih aminokislin in mikrohranil, kar bi lahko vplivalo na proizvodnjo H2S. Drugi viri nastanka neprijetnega vonja, podobnega žveplu, so lahko razgradnja metionina kot vira aminoskupine, pomanjkanje pantotenske kisline (vitamina) v moštih z visoko vsebnostjo YAN‐a, ter zmanjšanje vsebnosti elementarnega žvepla, ki se uporablja kot fungicid v vinogradih, ali pa uporaba fitofarmacevtskih sredstev, ki vsebujejo žveplo. Ob običajnem poteku fermentacije (to je brez težav, upočasnitev ipd.), prej omenjeni dejavniki ne prispevajo bistveno k nastanku H₂S (Wang s sod., 2003; Zoecklein, 2008;).
Vloga dušika v metabolizmu hlapnih spojin
Poleg etanola in ogljikovega dioksida, ki sta glavna produkta alkoholne fermentacije, kvasovke proizvajajo tudi širok spekter sekundarnih metabolitov, kot so na primer estri, hlapne maščobne kisline, višji alkoholi in hlapne žveplove spojine. Ti metaboliti pomembno prispevajo k okusu in aromi vina. Kvasovke vrste S. cerevisiae običajno uporabljajo amonijak ali glutamin kot glavna vira dušika. Če pa zmanjka teh virov, lahko kvasovke začnejo razgrajevati asimilirane aminokisline po Ehrlichovi poti (Slika 5), da bi zadovoljile svoje potrebe po dušiku.
Po Ehrlichovi poti iz dušikovih spojin neposredno nastajajo nekatere fermentacijske arome, kot so višji alkoholi in acetatni estri (Slika 5).
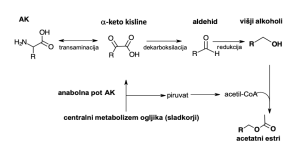
Slika 5. Ehrlichova pot razgradnje aminokislin (AK) pri kvasovkah (prirejeno po Cordente s sod., 2019)
Ehrlichova metabolna pot v treh korakih:
- transaminacija amino kislin v a-keto kisline
- dekarboksilacija a-ketokisline v aldehid
- konverzija aldehida v kislino ali višje alkohole
Pri deaminaciji (transaminaciji) aminokislin (reakcija odstranitve aminoskupine) iz ostanka ogljikove verige nastanejo višji alkoholi. Ti se s pomočjo encima acetiltransferaze pretvorijo v acetatne estre. Višji alkoholi lahko nastanejo po Ehrlichovi poti razgradnje dušika (Slika 5) ali pa poti metabolizma ogljika, ki je anabolna pot.
Višji alkoholi lahko v velikih koncentracijah (večji od 300 mg/L) negativno vplivajo na organoleptične lastnosti ter kakovost vina. V manjših količinah pa lahko pozitivno prispevajo k aromi vina. Nekateri višji alkoholi imajo prav tako zelo pomembno vlogo pri tvorbi aromatskih estrov, zato je uravnavanje razgradnje aminokislin ključno za vzpostavljanje ravnotežja. To bi lahko pojasnilo, zakaj so nekatere sorte grozdja v primerjavi z drugimi dovzetnejše za razvoj določenih arom in okusov ali ugodnejše za tvorbo H2S (tako imenovano reduktivno grozdje). Poleg tega bi to pojasnilo sezonske razlike v vinogradnih pri pridelavi iste sorte grozdja.
Druge dušikove spojine v moštu in vinu
Dejavniki rasti ali vitamini
Vitamini so rastni faktorji, ki sodelujejo pri presnovi kvasovk. Nekatere vitamine kvasovke sintetizirajo same, nekatere pa morajo pridobiti iz gojišča. Grozdni mošt običajno vsebuje zadostno količino vitaminov za nemoten potek fermentacije, vendar lahko pod določenimi pogoji pride do njihovega pomanjkanja. Vitamini delujejo kot kofaktorji v encimskih reakcijah in se med reakcijo kemijsko ne spremenijo (Castor, 1953), zato jih je mogoče uporabiti večkrat. Pomanjkanje vitamina je možno iz različnih razlogov, na primer zaradi okužbe s plesnijo (npr. Botrytis) na grozdnih jagodah in s čezmernimi dodatki DAP‐a (ki povzročajo neravnovesje vitaminov, ne pa nujno njihovega pomanjkanja). Zaradi okužbe s plesnijo iz grozdnih jagod se pred trgatvijo izčrpajo različna hranila, kar je eden od razlogov, zakaj so fermentacije iz botritičnega/ali gnilega grozdja skoraj vedno problematične. V takih primerih je pri fermentaciji treba dodajati hranila za kvasovke.
Najpomembnejši vitamini pri alkoholnem vrenju so biotin, tiamin in pantotenska kislina. Dodatek biotina v mošt lahko poveča populacijo kvasovk in pospeši fermentacijo. Biotin ima pomembno vlogo pri presnovi sladkorja, dušika in maščobnih kislin. Kvasovka ne more rasti brez biotina, a je na srečo za rast potrebna zelo majhna koncentracija (1 μg/L). Za doseganje optimalne rasti in želene proizvodnje hlapnih arom (prave koncentracije višjih alkoholov in estrov) je potrebna večja koncentracija (10 μg/L). Grozdni mošt običajno vsebuje 0,6–60,0 μg/L biotina (Evers s sod., 2021). Tiamin (vitamin B1) je pomembna sestavina mošta in se delno razgrajuje zaradi dodatka sulfita, ki preprečuje pojav neželenih organizmov. V EU‐ju je dovoljen dodatek tiamina do 50 mg/hL. Piridoksin (vitamin B6) ima vlogo v metabolizmu aminokislin – z dodatkom sredstev za bistrenje se zmanjšuje količina tega vitamina. Ob pomanjkanju pantotenske kisline in piridoksina je možna tvorba neželenih spojin, kot sta ocetna kislina in H2S (Xing in Edwards, 2006).
Biogeni amini
Biogeni amini so dušikove spojine, ki nastanejo iz aminokislin v reakciji dekarboksilacije z mlečnokislinskimi bakterijami. V vinu so najpogosteje prisotni histamin, putrescin, kadaverin, feniletilamin in drugi. Na vsebnost biogenih aminov po eni strani vplivajo pogoji pridelave vina, tehnike vinifikacije, staranje vina, kmetijske prakse in podnebne razmere (Ortega‐Heras s sod., 2014), po drugi strani pa vrste mikroorganizmov (ki jih proizvajajo z encimi dekarboksilazami), vsebnost prekurzorjev aminokislin v mediju, pa tudi parametri vina (pH, koncentracija alkohola, prisotnost žveplovega dioksida), ki vplivajo na rast bakterij. Vsebnost teh spojin je v enologiji ključna, saj so pomembni pokazatelji kakovosti vina (Smit s sod., 2008; Moreno‐Arribas s sod., 2010; Ortega‐Heras s sod., 2014).
Viri
Amerine, M. A., Berg, H. W., Kunkee, R. E., Ough, C. S., Singleton, V. L., Webb, A. D. (1980). The composition of grapes. The technology of wine making. 4. izdaja AVI Publishing Company: Westport, Connecticut, 77–139. https://primopmtca01.hosted.exlibrisgroup.com/primoexplore/fulldisplay/01SFUL_ALMA21178231760003611/SFUL
Bell A. A., Ough C. S., Kliewer W. M. (1979). Effects on must and wine composition, rates of fermentation and wine quality of nitrogen fertilization Vitis vinifera var. Thompson Seedless grapevines. Am. J. Enol. Vitic.,30(2), 124–129. https://doi.org/10.5344/ajev.1979.30.2.124
Bell, S. J., Henschke, P. A. (2005). Implications of nitrogen nutrition for grapes, fermentation and wine. Aust. J. Grape Wine R., 11 (3), 242–295. https://doi.org/10.1111/j.1755- 0238. 2005.tb00028.x
Beltran, G., Esteve-Zarzoso, B., Rozès, N., Mas, A., Guillamón, J. M. (2005). Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption. J. Agric. Food Chem. 53(4), 996–1002. https://doi.org/10.1021/jf0487001
Boulton, R. B., Singleton, V. L., Bisson, L. F., Kunkee, R. E. (1996). Principles and Practices of Winemaking. Chapman & Hall, New York, 146–150. https://www.scribd.com/doc/137738857/Principles-and-Practices-of-Winemaking
Carrascosa A. F., Muñoz R., González R. (2011). Molecular wine microbiology, Academic Press Elsevier, 1. Izdaja.
Castor, J. G. B. (1953). The B-complex vitamins of musts and wines as microbial growth factors. Appl. Microbiol., 1(2), 97–102. https://doi.org/10.1128/am.1.2.97-102.1953
Cooper, T. G. (1982). Nitrogen metabolism in Saccharomyces cerevisiae. In: Strathern, J.N., Jones, E.W., Broach, J. R. (Eds.). The Molecular Biology of the Yeast Saccharomyces: Metabolism and Gene Expression, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 39–99.
Cooper, J. D. H., Ogden, G. , McIntosh, J., Turneel D. C. (1984). The stability of the o-phthaldehyde/2-mercaptoethanol derivates of amino acids: an investigation using high pressure liquid chromatography with a pre-column derivatization technique. Anal. Biochem., 142, 98–102. https://doi.org/10.1016/0003-2697(84)90522-0
Cordente, A. G., Schmidt, S., Beltran, G., Torija, M. J., Curtin, C. D. (2019). Harnessing yeast metabolism of aromatic amino acids for fermented beverage bioflavouring and bioproduction. Appl. Microbiol. Biotechnol.,103, 4325–4336. https://doi.org/10.1007/s00253-019-09840-w
Cozzolino, D., Dambergs, R. G., Janik, L., Cynkar, W. U., Gishen, M. (2006). Analysis of grapes and wine by near-infrared spectroscopy. J. Near Infrared Spectrosc. 14: 279–289. https://doi.org/10.1007/s00253-019-09840-w
Dukes, B. C., Butzke. C. E. (1998). Rapid determination of primary amino acids in grape juice using an o-phthaldialdehyde/N-acetyl-L-cysteine spectrophotometric assay.
Am J. Enol. Vitic., 49, 125–134. DOI:10.5344/ajev.1998.49.2.125
Evers, M. S., Roullier-Gall, C., Morge, C., Sparrow, C., Gobert, A., Alexandre, H. (2021). Vitamins in wine: Which, what for, and how much? Compr. Rev. Food Sci. Food Saf., 20, 2991–3035. https://doi.org/10.1111/1541-4337.12743
Godard, P., Urrestarazu, A., Vissers, S., Kontos, K., Bontempi, G., van Helden, J., André, B. (2007). Effect of 21 different nitrogen sources on global gene expression in the yeast Saccharomyces cerevisiae. Mol. Cell. Biol., 27, 3065–3086. https://doi.org/10.1128/mcb.01084-06.
Henschke, P. A., Jiranek, V. (1993), Yeasts-metabolism of nitrogen compounds in wine microbiology and biotechnology. Aust. Wine Res. Inst., 77–164.
Iland, P., Ford, C., Bruer, D., Wilkes, E., Bruer, N. (2021). Theory and concepts of chemical, physical and sensory analyses and tests of grapes and wine, Patrick Iland Wine Promotions Pty Ltd.
Jiranek, V., Henschke, P. A. (1991). Assimilable nitrogen: regulator of hydrogen sulphide production during fermentation. Aust. Grapegrower Winemaker, 328, 27 – 30.
Jiranek, V., Langridge, P., Henschke, P. A. (1995). Amino acid and ammonium utilization by Saccharomyces cerevisiae wine yeasts from a chemically defined medium. Am. J. Enol. Vitic. 46(1), 75–83. DOI: 10.5344/ajev.1995.46.1.75
Large, P. J. (1986). Degradation of organic nitrogen compounds by yeasts. Yeast 2, 1–34. https://doi.org/10.1002/yea.320020102
Llauradó i Reverchon J. M., (2002). Avaluació dels condicionants del most en el desenvolupament de la fermentació alcohòlica a baixes temperaturas. Doctoral thesis. Tarragona, Spain: Universitat Rovira i Virgili.
Mendes-Fereira, A., Barbosa, C., Inês, A., Mendes-Faia, A. (2010). The timing of diammonium phosphate supplementation of wine must affects subsequent H2S release during fermentation. J. Appl. Microb., 108(2), 540–549. https://doi.org/10.1111/j.1365-2672.2009.04457.x
Mirvish, S. S., Smyrk, T., Payne, S., Tuatoo, H., Chen, S. C. (1994). Weak carcinogenicity of 2-hydroxyethyl carbamate in strain A mice: indication that this is not a proximal metabolite of ethyl carbamate. Cancer Lett., 77(1), 1–5. https://doi.org/10.1016/0304-3835(94)90340-9
Monteiro, F. F., Bisson, L. F. (1992). Nitrogen Supplementation of Grape Juice. I. Effect on Amino Acid Utilization During Fermentation. Am. J. Enol. Vitic. 43, 1–10. https://doi.org/10.5344/ajev.1992.43.1.1
Moreno-Arribas, M. V., Smit, A. Y., du Toit, M. (2010). Biogenic amines and the winemaking process. In Understanding and Managing Wine Quality and Safety; Reynolds, A.G., Ed.; Woodhead Publishing Limited: Cambridge, UK. http://dx.doi.org/10.1533/9781845699987.2.494
O’Kennedy, K., Reid, G. (2008). Yeast nutrient management in winemaking, The Australian and New Zeal. Grapegrower Winemaker. 537, 92–100.
Ortega-Heras, M., Pérez-Magariño, S., Del-Villar-Garrachón, V., González-Huerta, C., Moro Gonzalez, L.C., Guadarrama Rodríguez, A., Villanueva Sanchez, S., Gallo González, R., Martín de la Helguera, S. (2014). Study of the effect of vintage, maturity degree, and irrigation on the amino acid and biogenic amine content of a white wine from the Verdejo variety. J. Sci. Food Agric. 94, 2073–2082. https://doi.org/10.1002/jsfa.6526
Ough, C. S., Amerine, M. A. (1988). Methods Analysis of Musts and Wines. John Wiley and Sons, New York. 2. izdaja, Wiley.
Petrovic, G., Aleixandre-Tudo, J. L., Buica, A., (2019). Grape Must Profiling And Cultivar Discrimination Based On Amino Acid Composition And General Discriminant Analysis With Best Subset. S. Afr. J. Enol. Vitic., 40, 2. http://dx.doi.org/10.21548/40-2-3373.
Ribéreau-Gayon P. (2000), Handbook of Enology, The Microbiology of Wine and Vinifications, Wiley.
Sablayrolles, J.-M., Dubois, C., Manginot, C., Roustan, J.-L., Barre, P. (1996). Effectiveness of combined ammoniacal nitrogen and oxygen additions for completion of sluggish and stuck wine fermentations. J. Ferment. Bioengin. 82(4), 377–381. https://doi.org/10.1016/0922-338X(96)89154-9
Smit, A. Y. Y., Du Toit, W. J. J., Du Toit, M. (2008). Biogenic amines in wine: Understanding the headache. S. Afr. J. Enol. Vitic. 29, 109–127. https://doi.org/10.21548/29-2-1444
Sørensen, S. P. L. (1907) Enzymstudien I: Über die quantitative Messung proteolytischer Spaltungen, Die Formoltitrierung – Biochem. Zeit.
Sørensen, H., Sørensen, S., Bjergegaard, C., Michaelsen, S. (1999). Chromatography and capillary electrophoresis in food analysis. Royal Society Chemistry Press, Cambridge.
Stevens, D. F., Ough, C. S., (1993). Ethyl carbamate formation: reaction of urea and citrulline with ethanol in wine under low to normal temperature conditions. Am. J. Enol. Vitic., 44, 309–312. DOI: 10.5344/ajev.1993.44.3.309
Suárez-Lepe, J., Uthurry, C. (2007). Incidence of nitrogenous compounds of must on ethyl carbamate formation induced by lactic acid bacteria J. Int. Sci. Vigne Vin. 41(4), 215–223. https://doi.org/10.20870/oeno-one.2007.41.4.842
Thomas, C. S., Boutlon, R. B., Silacci, M. W., Gubler, D. W. (1993). The effect of elemental sulfur, yeast strain, and fermentation medium on hydrogen sulfide production during fermentation. Am. J. Enol. Vitic. 44, 211–216. DOI: 10.5344/ajev.1993.44.2.211
Ugliano, M., Henschke, P. A., Herderich, M. J., Pretorius, I. S. (2007). Nitrogen management is critical for wine flavour and style. Aust. N. Z. Wine Ind. J., 22, 6, 24–30.
Verdenal, T., Dienes-Nagy, Á., Spangenberg, J. E., Zufferey, V., Spring, J.-L., Viret, O., Marin-Carbonne, J., Leeuwen, C. (2021). Understanding and managing nitrogen nutrition in grapevine: a review. OENO One 1, 1–43. https://doi.org/10.20870/oeno-one.2021.55.1.3866
Vos, P. J. A., Zeeman, W., Heymann, H. (1978). The effect on wine quality of di-ammonium phosphate additions to musts. Proceedings: S. Afr. J. Enol. Vitic., 87–104.
Vos, P. J. A., Gray, R. S. (1979). The origin and control of hydrogen sulphide during fermentation of grape must. Am. J. Enol. Vitic. 30, 187–197. DOI: 10.5344/ajev.1979.30.3.187
Vos, P. J. A. (1993). Evaluation of 27 internationally available yeast strains with special reference to fermentation activity, assimilable nitrogen, composition of metabolites and the sensory qualities of wines. 10th International Enological Symposium, Montreux, Switzerland.
Wang, X. D., Bohlscheid, J. C., Edwards, C. G. (2003). Fermentative activity and production of volatile compounds by Saccharomyces cerevisiae in synthetic grape juice media deficient in assimilable nitrogen and/or pantothenic acid. J. Appl. Microbiol., 94, 349 – 359. https://doi.org/10.1046/j.1365-2672.2003.01827.x
Weeks, S. M., Henschke, P. A. (2007). Yeast assimilable nitrogen. The Australian Wine Research Institute’s Analytical Service. Oct. 2007.
Xing, H., Edwards, C. E. (2006). Impact of thiamine and pyridoxine on wine fermentation. Am. J. Enol. and Vitic., 57(3), 393A–393A.
Zoecklein, B. W., Fugelsang, K. C., Gump, B. H., Nury, F. S. (1995). Nitrogen Compounds. In: Wine Analysis and Production. Springer, Boston, MA. https://doi.org/10.1007/978-1-4757-6978-4_8
Zoecklein, B. W. (2008). Management of sulphur-like off odours in wine, a HACCP plan. Enology notes 139.
