1 Napredne sklopljene kromatografske tehnike za določanje glavnih metabolitov v (brez)alkoholnih pijačah
Mitja Martelanc
Center za raziskave vina, Fakulteta za vinogradništvo in vinarstvo, Univerza v Novi Gorici, Glavni trg 8, Vipava
mitja.martelanc@ung.si
Uvod
Sladkorji in organske kisline kot esencialni primarni metaboliti igrajo ključno vlogo pri razvoju grozdnih jagod vinske trte in jabolk pa tudi pri proizvodnji soka, vina in ciderja, kjer se v procesu fermentacije pretvorjajo sladkorji v etanol. Tako so poleg vrednosti pH ter prostega in skupnega žvepla, sladkorji, organske kisline in etanol ključni kemijski parametri, ki se jih določa v procesih kontrole kakovosti od pridelave grozdja in jabolk ter soka, vina in ciderja, saj pomembno vplivajo na organoleptične lastnosti, mikrobiološko in kemično stabilnost (brez)alkoholnih pijač in kot taki prispevajo k splošni kakovosti (brez)alkoholnih pijač. Zato je proces fermentacije po svoji naravi najbolj kritičen korak v proizvodnji alkoholnih pijač. Pri fermentaciji je bistvenega pomena hitra in natančna določitev organskih kislin, etanola in sladkorjev z minimalno pripravo vzorca. Hitra, natančna in točna analitika tovrstnih vzorcev je še posebej potrebna na raziskovalnem področju, ko se mikro-fermentacije izvajajo v velikem obsegu in se med poskusi analizirajo le majhne količine velikega števila vzorcev. Poleg tega je jabolčno-mlečnokislinska fermentacija zelo pomemben korak v proizvodnji vina in ciderja in jo je kot tako treba nadzorovati, pri čemer mora biti pretvorba jabolčne kisline v mlečno kislino izvedena hitro in kvantitativno oziroma jo je potrebno celo zaustaviti pri določeni ravni mlečne in jabolčne kisline.
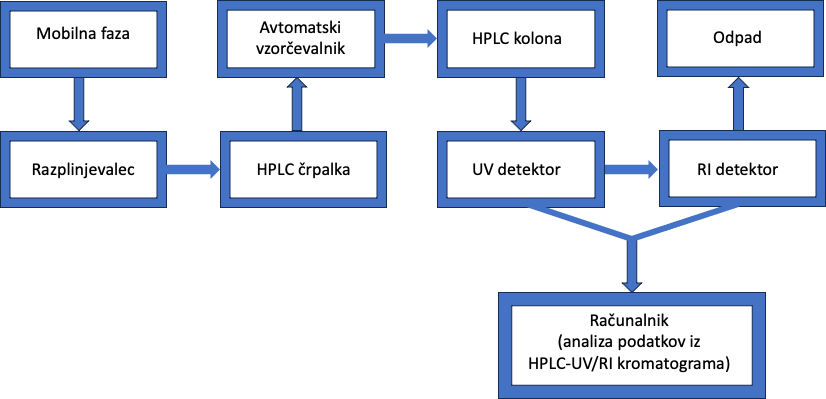
Sklopljene kromatografske tehnike, ki združujejo ločevanje s pomočjo tekočinske kromatografije visoke ločljivosti (HPLC) sklopljene z ultravijoličnim (UV) detektorjem in detektorjem lomnega količnika (RI), shematično prikazano na Sliki 1, omogočajo avtomatizirano, zanesljivo, robustno, hitro in natančno določanje glavnih sladkorjev, organskih kislin in etanola v pijačah (Riccardo, 2008). Poleg tega je potrebna minimalna priprava vzorca, in sicer filtracija skozi 0,45 μm filter brez kakršne koli predhodne derivatizacije. Slika 2 prikazuje pravi sistem HPLC-UV/RI, ki se nahaja v Centru za raziskave vina Univerze v Novi Gorici z označenimi kmponantami.

Analiza sladkorjev
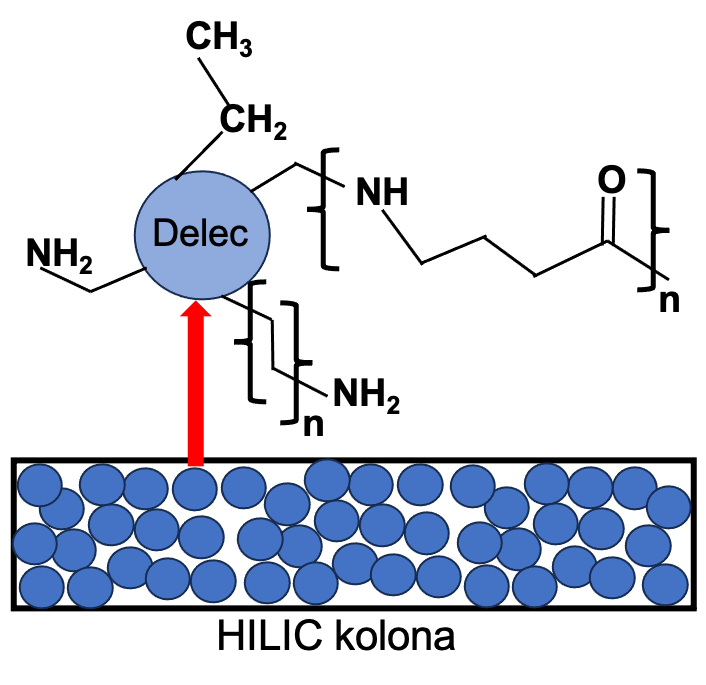
Sladkorje, predvsem glukozo, fruktozo in saharozo, lahko hitro in točno določimo v sokovih in alkoholnih pijačah s HPLC kolonami na osnovi hidrofilne interakcijske tekočinske kromatografije (HILIC) brez predpriprave vzorca v kombinaciji z detektorjem na lomni količnik (RI). HILIC kolona omogoča ustrezno zadrževanje in selektivnost ločevanja med polarnimi analiti kot so fruktoza, glukoza in saharoza kot glavni sladkorji v pijačah. Primer modifikacije HILIC silikagelne kolone s poliamidnimi/aminskimi funkcionalnimi skupinami prikazuje slika 3 (Buszewski in Noga, 2012).
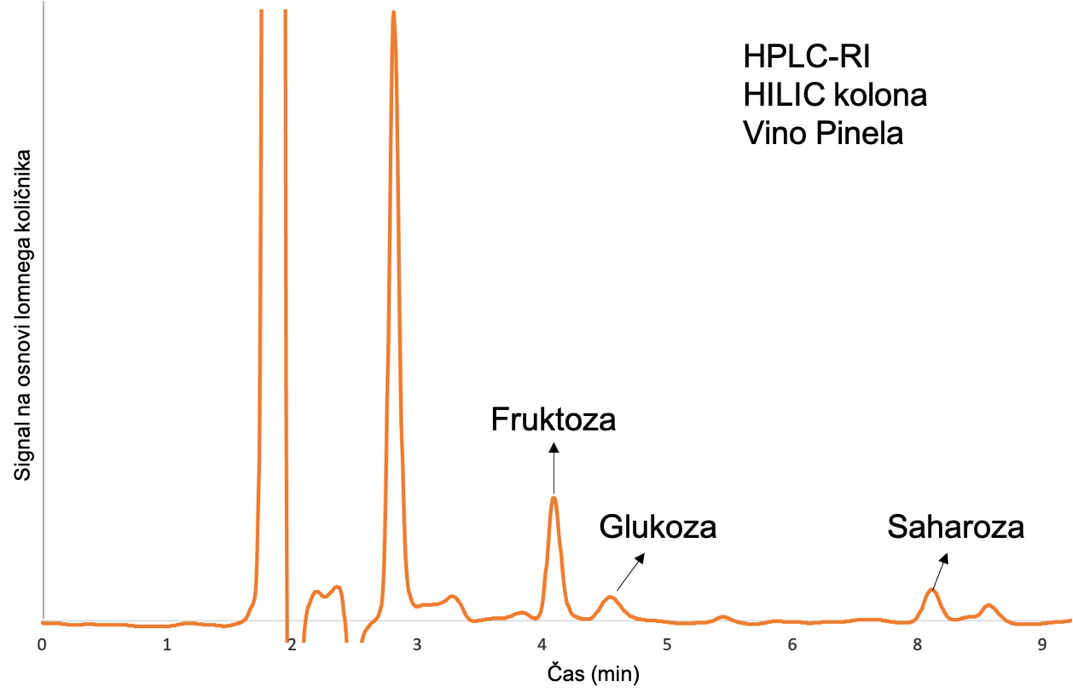
Primer uspešnega ločevanja in kvantifikacije je uporaba termostatirane HILIC kolone pri 30 °C z dimenzijami 150 mm x 4,6 mm in velikostjo delcev 3 um (Øvsthus in sod., 2024; Česnik in sod., 2023). Hitrost pretoka mobilne faze, ki jo sestavlja mešanica topil acetonitril/voda (75:25, v/v), je 0,9 mL/min. Detekcija in kvantifikacija spojin poteka s pomočjo RI detektorja. Slika 4 prikazuje HPLC-RID ločbo fruktoze, glukoze in saharoze v vzorcu vina Pinela. Glukoza (0,2 g/L) je v slednjem vzorcu prisotna v sledeh, med tem ko je vsebnost fruktoze večja (1,5 g/L). Glede na to, da ima ta metoda nizko mejo zaznave in mejo določanja (0,01 g/L oziroma 0,03 g/L), je bilo možno ovrednotiti tudi sledi saharoze v koncentraciji okoli 0,2 g/L.
HPLC kolone bazirane na polimernem nosilcu
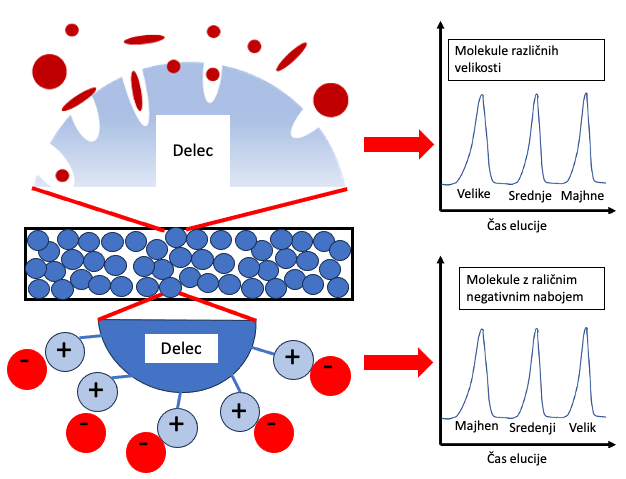
HPLC kolone na osnovi polimerne stacionarne faze lahko hkrati omogočajo več mehanizmov ločevanja, in sicer prek ionske izmenjave, izključitve, hidrofobnih interakcij, vodikove vezi in π- π interakcij ter omogočajo delovanje v širšem območju pH (1-14). Na sliki 5 sta prikazana dva od mehanizmov (Nguyen, 2022). Te kolone omogočajo sočasno določevanje organskih kislin, sladkorjev in alkoholov. Kljub dejstvu, da takšne HPLC kolone zagotavljajo določevanje omenjenih spojin, imajo določene slabosti in sicer prihaja do nepopolne ločbe oziroma interferenc med citronsko kislino in vinsko kislino, vinsko kislino in glukozo ter med jabolčno kislino in fruktozo, kot je prikazano na Sliki 6. Te omejitve ločevanja zmanjšajo uporabo takšnih kolon, saj so sladkorji in glavne organske kisline v moštu, vinu in jabolčniku najpomembnejši parametri kontrole kakovosti. Po drugi strani pa je mogoče natančno določiti etanol, metanol, glicerol, jantarno kislino (sukcinska kislina), piruvično kislino in ocetno kislino s kombiniranjem takih zmožnosti ločevanja v kombinaciji z UV in RI detektorji.
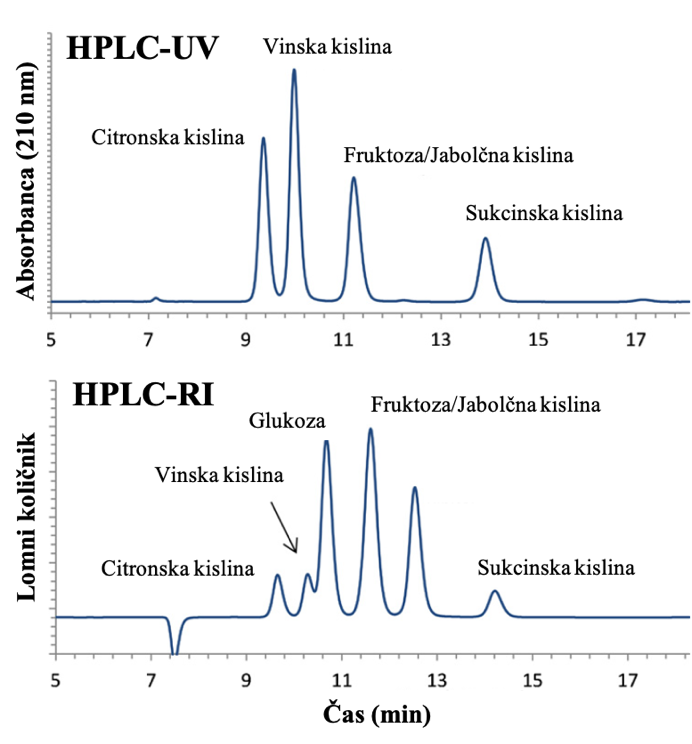
Hkratno določanje glavnih organskih spojin z uporabo revrzno faznega HPLC-UV-RID sistema
HPLC kolone z reverzno fazo (C18) so najbolj vsestranske in najbolj pogosto uporabljene kolone v analitskih laboratorijih zaradi svoje vzdržljivosti, visokih zmogljivosti ločevanja in možnosti uporabe v številnih aplikacijah. Tako je tukaj predstavljena preprosta, točna in učinkovita metoda za sočasno kvantifikacijo organskih kislin (vinska, jabolčna, mlečna, ocetna in citronska kislina), sladkorjev (glukoza + fruktoza) in etanola z uporabo dveh kolon na osnovi reverzne faze, povezanih z UV/RI detekcijo. Da bi dosegli ustrezno zadrževanje visoko polarnih spojin, kot so sladkorji in organske kisline, se kot mobilna faza uporablja vodna raztopina H2SO4. Za uspešno ločitev med vsemi merjenimi spojinami, se uporabi dve različni reverzno fazni koloni, ki sta zaporedno vezani (Slika 7), in sicer stacinorani fazi na osnovi pentafluorofenilne (PFP) funkcionalne skupine v kombinaciji s C18 polnilom (oktadecilna linearna veriga nasičenega ogljikovodika) (Øvsthus in sod., 2024).
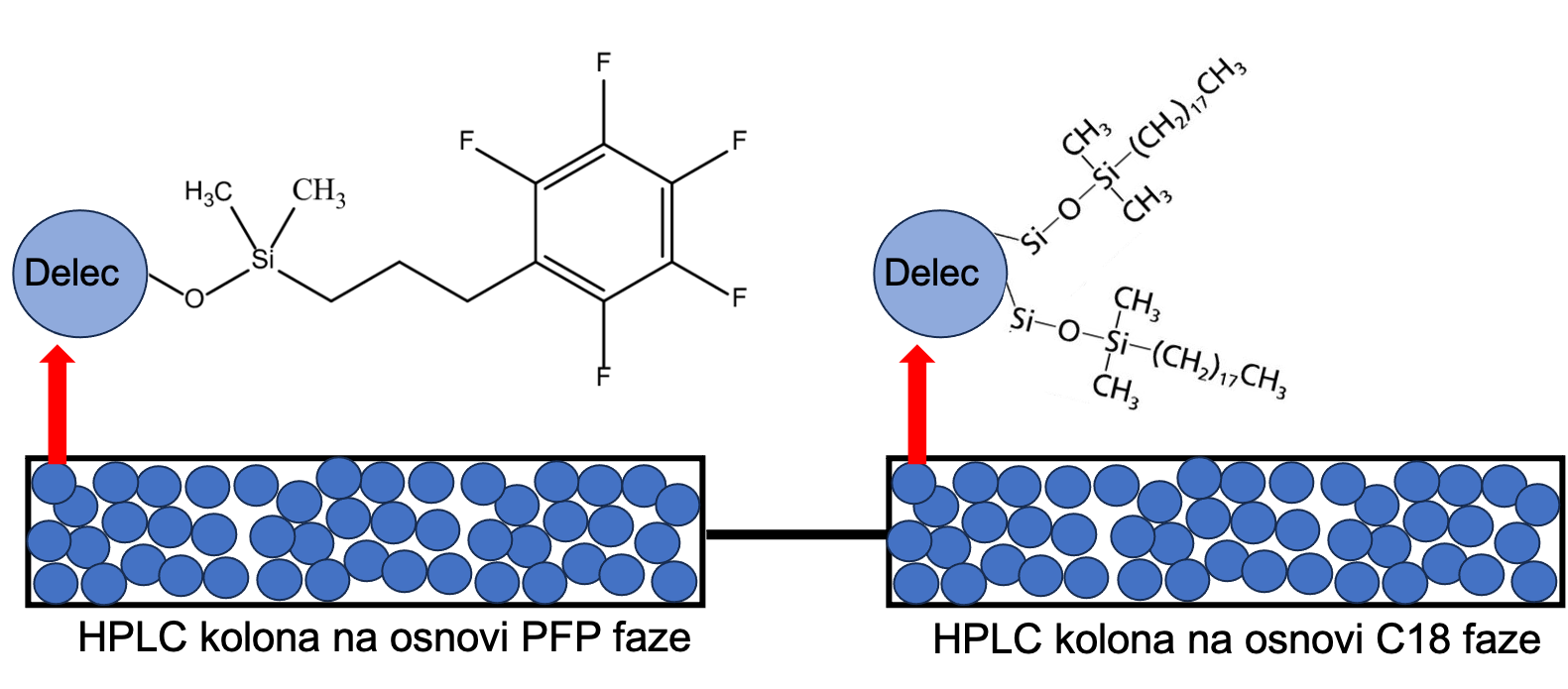
Določanje vinske, jabolčne, mlečne, ocetne in citronske kisline, sladkorjev (glukoza + fruktoza) in etanola poteka na dveh HPLC kolonah, ki sta zaporedno vezani skupaj: Kinetex PFP (dimenzije 100 x 4,6 mm z velikostjo delcev 2,6 μm) s predkolono (dolžine 5 mm in ø 4,6 mm, velikost delcev 2,6 μm) in C18 Kinetex EVO (dimenzije 250 x 4,6 mm z velikostjo delcev 5 μm). Volumen vbrizga je 4 μL, mobilna faza je 5 mM vodna raztopina H2SO4, hitrost pretoka je 0,7 mL/min.
Kot je prikazano na Sliki 8, je HPLC-UV/RI analiza standardne raztopine mešanice zgoraj omenjenih sedmih spojin narejena v 8 minutah, medtem ko Slika 9 prikazuje HPLC-UV/RI analizo 7 spojin v moštu, moštu v fermentaciji, vinu, jabolčnemu soku in ciderju pred in po jabolčno-mlečni fermentaciji. Ocetne kisline nismo zaznali, saj je bila njena koncentracija v vzorcih pod 0,2 g/L.
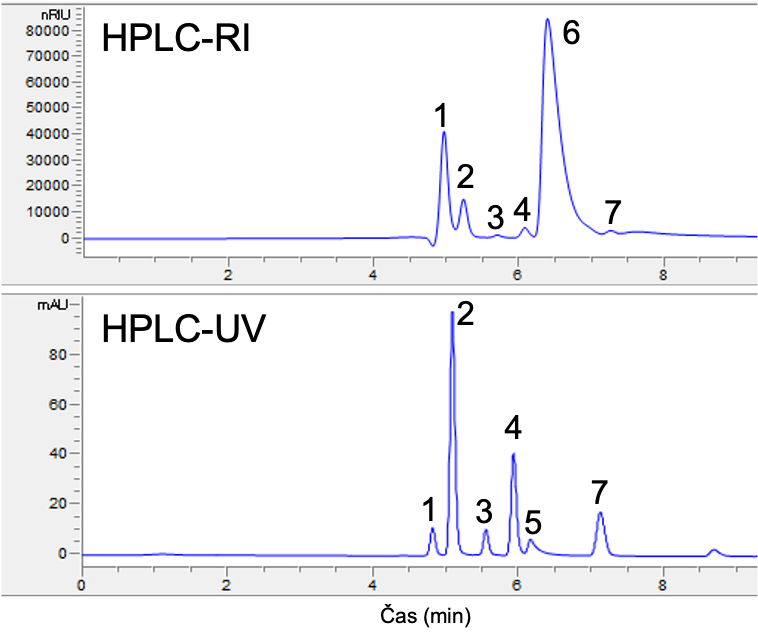
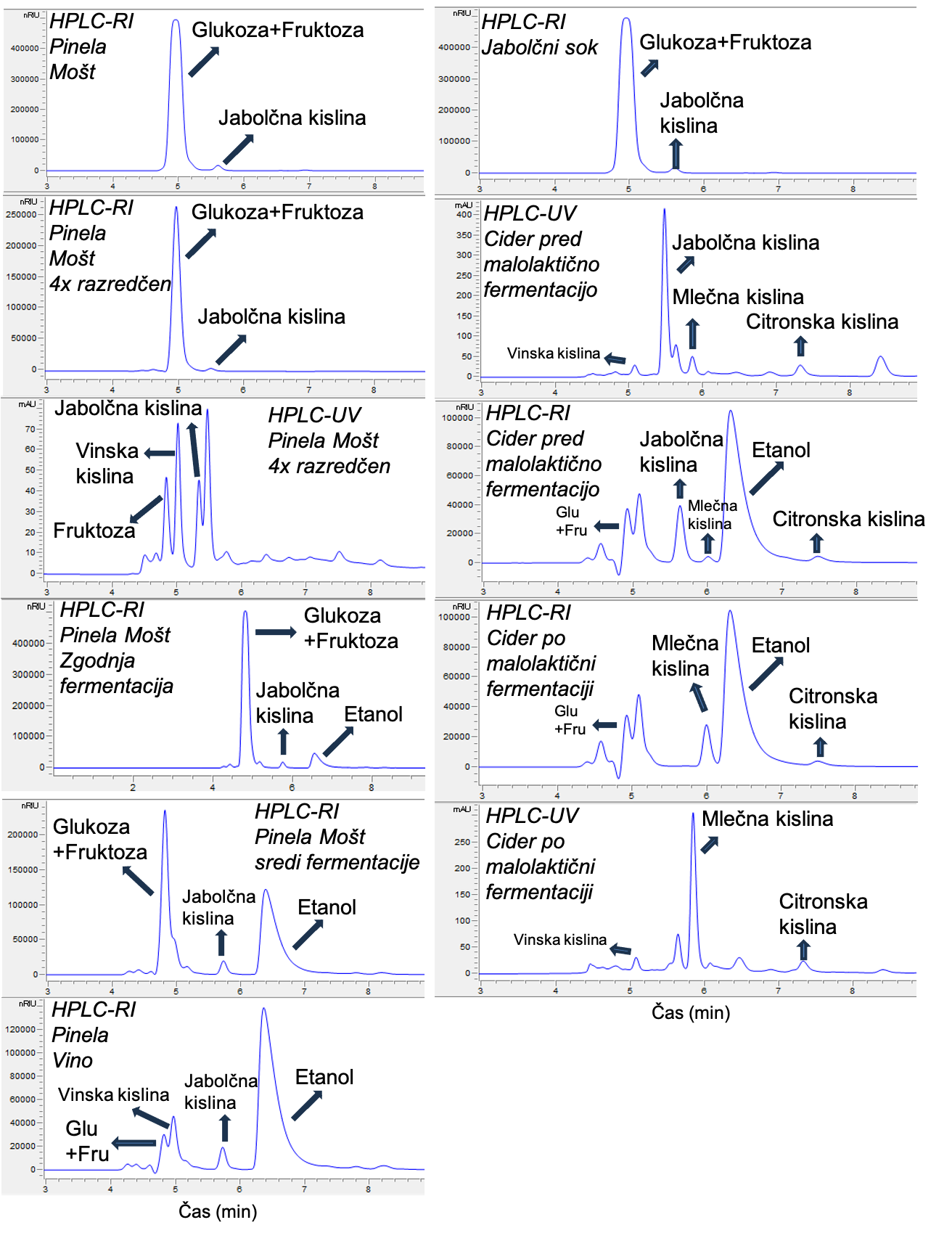
Primer uporabe metode
Določanje koncentracij merjenih kemijskih parametrov v realnih vzorcih
Pri uporabi HPLC-UV/RI metod imamo opravka z instrumentalno tehniko, pri čemer je izmerjen signal (ploščina kromatografskega vrha) na UV in RI detektorju odvisen od koncentracije merjenega analita (Slika 10). Oba detektoja je potrebno umeriti pri čemer so uporabljene metode umerjanja pri instrumentalni analizi v večini primerov relativne. Pri postopku umerjanja (kalibracije) ugotovimo zvezo med merjenim signalom (absorbanca analita pri UV detektorju in odklon svetlobe pri RI detektorju, v obeh primerih izraženim kot ploščina kromatografskega vrha) in dejansko koncentracijo analita (Skoog in sod., 1999). Pri HPLC tehniki je najbolj uporabna metoda eksternega standarda pri čemer za raztopine znanih koncentracij analita izmerimo intenziteto signala na detektorju. Največkrat pri tem dobimo linearno zvezo med signalom in koncentracijo (premico) z Enačbo 1.
y = k×x + n (Enačba 1)
y – ploščina kromatografskega vrha;
k – naklon premice;
x – koncentracija analita;
n – odsek na osi y.
Metoda standardnega dodatka se tudi uporablja za določanje vsebnosti analitov, vendar slednja metoda zahteva veliko več dela in analiz za posamezen vzorec. Metoda standardnega dodatka se pa v večini primerov uporablja za izračun izkoristka metode, s slednjo metodo namreč določimo točnost analizne metode za vsak posamezen analit v vzorcu.
Umeritveno krivuljo dobimo tako, da analiziramo standardne raztopine analita, ki vsebujejo različne znane koncentracije analita v ustreznem koncentracijskem razoponu (slika 10B), pri čemer mora dati UV detektor linearen odziv (Slika 11). Nekatere vzorce je potrebno pred meritvijo ustrezno razredčiti (ali skoncentrirati na primeren način), tako da je koncentracija določevane komponente v koncentracijskem območju umeritvene krivulje. Nato določimo ploščino kromatografskega vrha iz HPLC-UV kromatograma vzorca za izbran analit kot kaže slika 11 ter vstavimo ploščino v enačbo 1 in izračunamo koncentracijo analita: x = (y – n) / k.
Pri metodi standardnega dodatka dodamo raztopini vzorca znano količino merjenega analita. Vzorec kot tudi vzorec z dodatkom analita anliziramo tako, da določimo koncentracijo merjenega analita v obeh vzorcih preko dobljenih ploščin kromatografskega vrha. Izkoristek metode (% R) za merjen analit izračunamo s pomočjo enačbe 2:
% R = 100*(Cvzorec+dodatek – Cvzorec)/Cdodatek(Enačba 2)
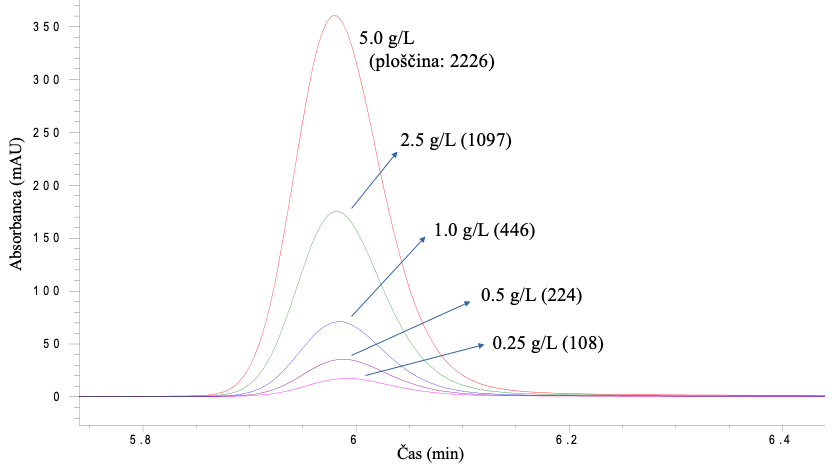
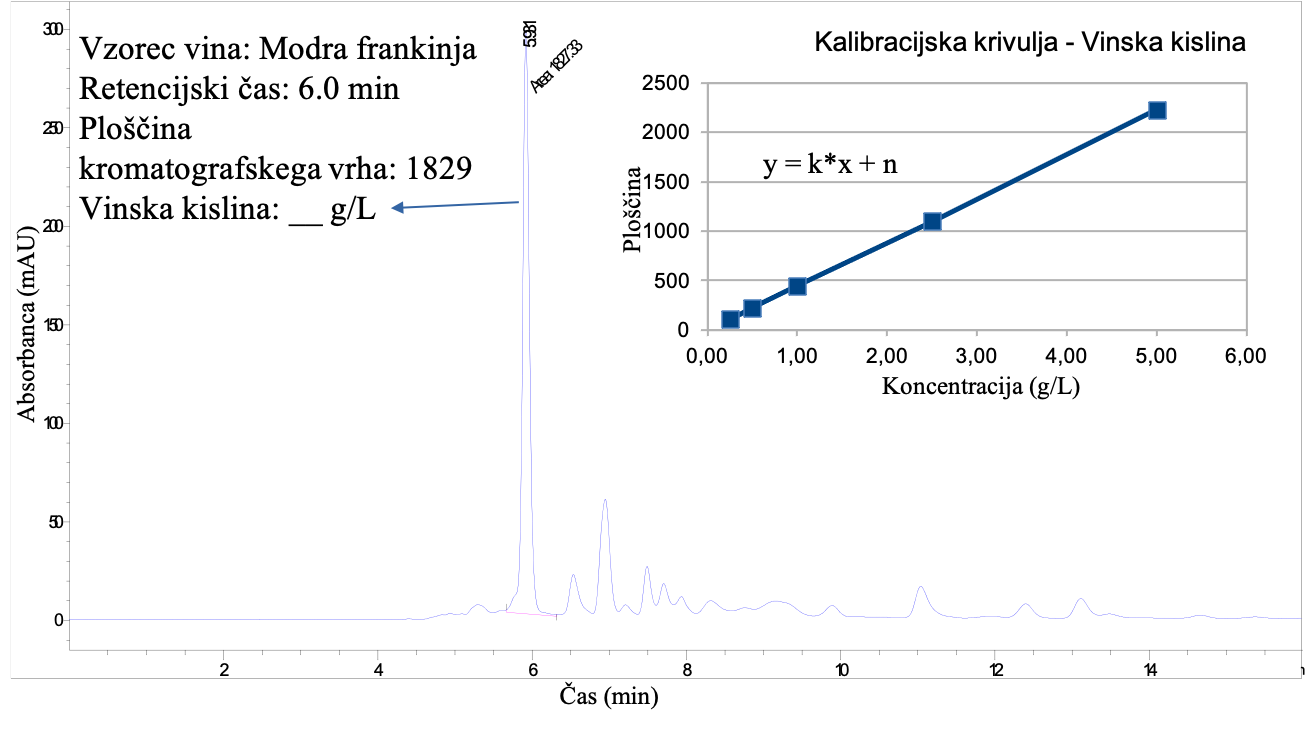
Pri analizi vinske kisline v vzorcu vina dobimo HPLC-UV kromatogram, kjer je prikazan integriran kromatografski vrh za vinsko kislino z ustrezno ploščino (Slika 11) pri valovni dolžini 210 nm. Na sliki 10 pa so prikazani signali za različne koncentracije standardnih raztopin vinske kisline. Iz teh podatkov pridobite umeritveno krivuljo (linearna premica) s pomočjo programa (npr. Excel) in izračunajte koncentracijo vinske kisline s pomočjo Enačbe 1.
Pri validaciji HPLC-UV metode smo uporabili metodo standardnega dodatka za izračun izkoristka metode. Vzorcu vina (analiziran in prikazan na sliki 11) smo dodali standardni dodatek vinske kisline v višini 2 g/L. Analiza slednjega vzorca je dala ploščino kromatografskega vrha za vinsko kislino 1977. Na podlagi vseh navedenih podatkov izračunajte izkoristek metode s pomočjo Enačbe 2.
Povzetek
Namenska HPLC kolona za ciljno analizo, kot v primeru analize sladkorja z uporabo stacionarnih faz HILIC, omogoča hitro in zelo točno določanje fruktoze, glukoze in saharoze v katerem koli homogenem tekočem vzorcu mošta, vina ali ciderja. Po drugi strani pa HPLC kolona na osnovi polimerne stacinarne faze (več različnih mehanizmov hkratnega ločevanja) omogoča hitro in sočasno analizo večjega števila spojin v eni analizi (sladkorji, alkoholi in organske kisline), vendar pa je točnost določanja sladkorjev in nekaterih organskih kislin slaba. Po drugi strani je mogoče natančno določiti metanol, etanol, glicerol, ocetno, jantarno in piruvično kislino, medtem ko slednjih spojin ni mogoče določiti z uporabo zgoraj omenjene HILIC kolone. Kompromis med visoko točnostjo in številom parametrov za nadzor kakovosti, ki jih je mogoče določiti hkrati, je mogoče doseči z uporabo dveh zaporedno vezanih kolon na osnovi reverzne faze. Zato je sistem reverzno fazni HPLC-UV/RI sistem še posebej uporaben za hitro, preprosto in točno določanje glavnih kemijskih parametrov pri spremljanju alkoholnih in malolaktičnih fermentacij.
Viri
Buszewski, B., & Noga, S. (2012). Hydrophilic interaction liquid chromatography (HILIC)—A powerful separation technique. Analytical and Bioanalytical Chemistry, 402(1), 231–247. https://doi.org/10.1007/s00216-011-5308-5
Česnik, U., Martelanc, M., Øvsthus, I., Radovanović Vukajlović, T., Hosseini, A., Mozetič Vodopivec, B., & Butinar, L. (2023). Functional characterization of Saccharomyces yeasts from cider produced in Hardanger. Fermentation, 9(9), 824. https://doi.org/10.3390/fermentation9090824
Nguyen, N. V. T. (2022). Analytical liquid chromatography – New perspectives. In Mixed-mode chromatography(Perspective chapter). IntechOpen. https://doi.org/10.5772/intechopen.104545
Øvsthus, I., Martelanc, M., Albreht, A., Radovanović Vukajlović, T., Česnik, U., & Mozetič Vodopivec, B. (2024). Chemical characterization of cider produced in Hardanger—From juice to finished cider. Beverages, 10(3), 73. https://doi.org/10.3390/beverages10030073
Øvsthus, I., Martelanc, M., Radovanović Vukajlović, T., Lesica, M., Butinar, L., Mozetič Vodopivec, B., & Antalick, G. (2023, April). Chemical composition of apple cider: A comparative study of Norwegian and French ciders. In III International Symposium on Beverage Crops (Vol. 1387, pp. 303–310). ISHS. https://doi.org/10.17660/ActaHortic.2023.1387.40
Riccardo, F. (2008). Hyphenated techniques in grape and wine chemistry. John Wiley & Sons, Ltd.
Skoog, D. A., & Holler, F. J. (1999). Analytical chemistry: An introduction (7th ed.). Brooks Cole.
