6 Analiza biogenih aminov v vinu in določanje sposobnosti mlečnokislinskih bakterij za tvorbo biogenih aminov
Jelena Topić Božič
Center za krožno gospodarstvo, Rudolfovo – Znanstveno in tehnološko središče, Novo mesto, Slovenija
Fakulteta za industrijski inženiring Novo mesto, Novo mesto, Slovenija
jelena.topic.bozic@rudolfovo.eu
Uvod
Biogeni amini, kot so histamin, kadaverin, putrescin in tiramin, so organske baze z nizko molekulsko maso, v človeškem metabolizmu pa regulatorji. Pogosto jih najdemo v fermentiranih živilih in pijačah, kot so sir, ribe in vino (Henríquez-Aedo in sod., 2016; Perestrelo in sod., 2020; Rivas in sod., 2005; Žurga in sod., 2019). Večina biogenih aminov v živilih izvira iz proteolitičnih procesov, s katerimi so na voljo aminokisline, ki so idealen substrat za encimske reakcije dekarboksilacije. Sinteza biogenih aminov je možna tudi z aminacijo in transaminacijo aldehidov in ketonov ob prisotnosti encimov transaminaz. Biogeni amini lahko nastanejo v sveži hrani, ki je izpostavljena mikroorganizmom z dekarboksilazno aktivnostjo, pa tudi v fermentirani in/ali predelani hrani (tj. vino, pivom idr.) kot posledica delovanja različnih procesov (npr. mlečnokislinska fermentacija) (Vinci in sod., 2021).
Uživanje živil in pijač, ki vsebujejo velike koncentracije biogenih aminov, lahko negativno vpliva na zdravje ljudi, saj povzročajo hipertenzijo, glavobol, drisko, zardevanje in slabost. Čeprav zakonske omejitve za biogene amine v vinih niso določene, so nekatere evropske države priporočile najvišje vrednosti za prisotnost histamina v vinih, vključno z Nemčijo (2 mg/L), Francijo (8 mg/L) in Belgijo (6 mg/L) (Konakovsky in sod., 2011; Martuscelli in sod., 2013; Martuscelli and Mastrocola, 2019; Vanda in sod., 2017). Najbolj znan toksični učinek, ki ga je mogoče pripisati zaužitju biogenih aminov, je t. i. skombroidni sindrom oz. histaminska zastrupitev, ki je posledica uživanja neustrezno shranjenih in nepravilno ohlajenih rib in nekaterih vrst sirov. Gre za bakterijsko kontaminacijo, ko določene vrste mikroorganizmov pretvorijo aminokislino histidin v histamin z encimom histidin dekarboksilaza. Prisotnost drugih biogenih aminov lahko sinergistično deluje na toksičnost histamina (Roškar and Roškar, 2020; Vinci in sod., 2021). Biogeni amini, prisotni v vinu, nastanejo v različnih stopnjah vinarskega procesa in skupaj prispevajo h koncentraciji v končnem vinu. Biogene amine lahko najdemo v grozdju (15–44 mg/kg), grozdnem soku (6–54 mg/l) in vinu (3–169 mg/l) (Martínez-Pinilla in sod., 2013; Moreira in sod., 2024; Prete in sod., 2009; Restuccia in sod., 2017), vendar se njihove količine precej razlikujejo v vsaki od teh matrik, k čemur prispeva več dejavnikov. Najvplivnejši dejavniki vključujejo koncentracijo prostih aminokislin, pH, temperaturo, fenotipske značilnosti fermentacijskih mikroorganizmov in razširjenost teh mikroorganizmov v vinu med staranjem (Belda in sod., 2016; Martínez-Pinilla in sod., 2013). Medtem ko je količina aminokislin in intrinzičnih biogenih aminov v grozdju dovzetnejša za vplive podnebja (Perestrelo in sod., 2020) in zdravja grozdov, je koncentracija biogenih aminov v moštu in vinu povezana s higiensko proizvodno prakso kleti, enološkimi praksami (Mir-Cerdà in sod., 2021), pa tudi s pridelavo vina, staranjem in pogoji shranjevanja (Landete in sod., 2005; Moreno-Arribas and Polo, 2008).
V Tabeli 1 so predstavljeni biogeni amini in njihovi fiziološki ter patološki vplivi. Na Sliki 1 so predstavljeni mehanizmi nastanka biogenih aminov iz prekurzorskih aminokislin z encimsko dekarboksilacijo.
Tabela 1. Fiziološke in patološke lastnosti izbranih biogenih aminov.
|
Biogeni amin |
Prekurzorska aminokislina |
Encim, odgovoren za dekarboksilacijo prekurzorske aminokisline |
Fiziološki učinki |
Patološki učinki |
Vir |
|
histamin
|
histidin
|
histidin dekarboksilaza |
|
alergijske reakcije:
|
(Kim in sod., 2023; Stratta and Badino, 2012; Tofalo in sod., 2016; Vinci in sod., 2021) |
|
tiramin
|
tirozin
|
tirozin dekarboksilaza |
|
|
(del Rio in sod., 2019; Kim in sod., 2023; Stratta and Badino, 2012; Vinci in sod., 2021) |
|
putrescin
|
ornitin
|
ornitin dekarboksilaza |
|
|
(del Rio in sod., 2024, 2019; Kim in sod., 2023; Stratta and Badino, 2012; Vinci in sod., 2021) |
|
kadaverin
|
lizin
|
lizin dekarboksilaza |
Nekatere mlečnokislinske bakterije, ki so naravno prisotne v grozdju, moštu in vinu, proizvajajo histamin, tiramin in putrescin (Coton in sod., 2010; Henríquez-Aedo in sod., 2016; Moreno-Arribas in sod., 2003; Nannelli in sod., 2008; Soufleros in sod., 1998). Vsak novi izolat mlečnokislinskih bakterij je treba najprej testirati za proizvodnjo biogenih aminov. Mlečnokislinske bakterije so manjši del mikrobiote grozdja in odgovorne za jabolčno-mlečnokislinsko fermentacijo (Barata in sod., 2012). Pomembno vplivajo na proces biološkega razkisanja vina, okus in mikrobiološko stabilnost (Guo in sod., 2015; Henríquez-Aedo in sod., 2016) ter predstavljajo skupino potencialno koristnih starterjev v vinski industriji. Uporaba avtohtonih starterskih kultur bi lahko izboljšala tipične značilnosti vinskih sort, ki bi se lahko izgubile, če bi uporabili komercialne starterje (Battistelli in sod., 2020; Emer in sod., 2021).
Analizne metode za določanje sposobnosti mlečnokislinskih bakterij za tvorbo biogenih aminov in določanje biogenih aminov v vinih
Metode določanja biogenih aminov lahko na splošno razdelimo na metode, ki zagotavljajo kvalitativne, in metode, ki zagotavljajo kvantitativne informacije (Coton in sod., 2010). Tehnike in metode, ki se uporabljajo pri analizi biogenih aminov, so predstavljene na Sliki 2.

Molekularne metode temeljijo predvsem na verižni reakciji s polimerazo (PCR) (Coton and Coton, 2005; Landete in sod., 2011; Nannelli in sod., 2008; Sebastian in sod., 2011) in se pojavljajo kot alternativa metodam tradicionalnih tehnik, kot je uporaba aminokislinsko-dekarboksilaznega medija (AADM) (Landete in sod., 2011). Fenotipske metode temeljijo predvsem na tankoplastni kromatografiji (TLC) in tekočinski kromatografiji visoke ločljivosti (metode HPLC) s korakom derivatizacije, z uporabo spojin, kot sta dansil klorid (Dns-Cl) ali o-ftalaldehid (Coton in sod., 2010; Prete in sod., 2009). Za določanje biogenih aminov v vinih se uporablja tudi plinska kromatografija z masno spektrometrijo (GC-MS) (Papageorgiou in sod., 2018), čeprav so analizne metode s tekočinsko kromatografijo pogostejše. Pri rutinski analizi biogenih aminov pozornost pridobivajo encimske in imunoencimske metode (Landete in sod., 2004) ter uporaba biosenzorjev (Lange and Wittmann, 2002; Leonardo and Campàs, 2016), saj na splošno veljajo kot cenovno ugodnejše metode, ki ne zahtevajo specializiranih instrumentov in obsežne priprave vzorcev (Neofotistos in sod., 2019; Papageorgiou in sod., 2018). Metode za določanje biogenih aminov se med seboj zelo razlikujejo. V Tabeli 2 so predstavljene izbrane lastnosti treh metod, ki se dandanes najpogosteje uporabljajo za analizo biogenih aminov (Topić Božič in sod., 2022):
Tabela 2. Primerjava HPLC-DAD, TLC in encimske metode za določanje biogenih aminov (Topić Božič in sod., 2022).
|
METODA |
HPLC-DAD |
TLC |
ENCIMSKA |
|
Najnižja meja detekcije (LOD) |
< 1 mg/L za putrescin, kadaverin, tiramin in histamin |
5 mg/L putrescin, kadaverin 10 mg/L histamin 20 mg/L tiramin |
25 mg/L histamin |
|
Čas, potreben za pripravo vzorca |
približno 2 uri |
približno 1,5 ure |
približno 15 min |
|
Čas, potreben za analizo vzorca |
Približen čas 37 min za vzorec (pribl. 2 uri za triplikat vzorca) |
pribl. 90 min za vzorec pribl. 90 min za triplikat vzorca pribl. 90 min za 4 vzorce v triplikatu* |
6 ur za vzorec 6 ur za triplikat vzorca 6 ur za 32 vzorcev v triplikatu (mikrotitrska plošča za 96 vzorcev) |
|
Poraba topil |
NAJVEČJA 37 mL na vzorec več kot 100 mL za triplikat vzorca |
SREDNJA Približno 10 mL na vzorec Približno 10 mL za triplikat vzorca* (12 vzorcev na TLC ploščo) |
NAJMANJŠA 0,16 mL na vzorec 0,48 mL za triplikat vzorca |
|
Stabilnost pripravljenih vzorcev |
DA Možna ponovna analiza vzorcev na HPLC po 14 dneh in shranjevanju vzorcev pri –20 °C Ni signifikantne spremembe velikosti in površine kromatografskih vrhov |
DA Možna ponovna analiza vzorcev in nanos na TLC plošče po 14 dneh in shranjevanju vzorcev pri –20 °C Pojavnost kromatografskih lis podobnih velikost |
NE |
|
Analiza biogenih aminov |
putrescin, kadaverin, tiramin in histamin |
putrescin, kadaverin, tiramin in histamin |
histamin |
* čas analize enega ali več vzorcev je pri TLC enak, ker se več vzorcev lahko nanese na isto TLC ploščo, katere se nato razvije v primernem topilu.
Vaje
Metode za določanje aktivnosti encimske dekarboksilaze in biogenih aminov
Kvalitativna metoda
Za kvalitativno določanje aktivnosti se uporablja tako imenovano gojišče AADM (medij, ki vsebuje prekurzorske aminokisline). Sestava gojišča AADM je prikazana v Tabeli 3. pH medija je 5.3.
Tabela 3. Sestava gojišča AADM (Bover-Cid in Holzapfel , 1999).
| Spojina | Koncentracija (v % m/v) |
| tripton | 0,5 |
| kvasni ekstrakt | 0,5 |
| mesni ekstrakt | 0,5 |
| natrijev klorid (NaCl) | 0,25 |
| glukoza | 0,05 |
| Tween 80® | 0,1 |
| magnezijev sulfat (MgSO4) | 0,02 |
| manganov sulfat (MnSO4) | 0,005 |
| železov sulfat (FeSO4) | 0,005 |
| amonijev citrat | 0,2 |
| tiamin | 0,001 |
| kalijev fosfat (K2PO4) | 0,2 |
| CaCO3 | 0,01 |
| piridoksal-5-fosfat | 0,005 |
| aminokislina (histidin, tirozin, lizin, ornitin) | 1,0 |
| bromkrezol vijolično | 0,006 |
| agar | 2 |
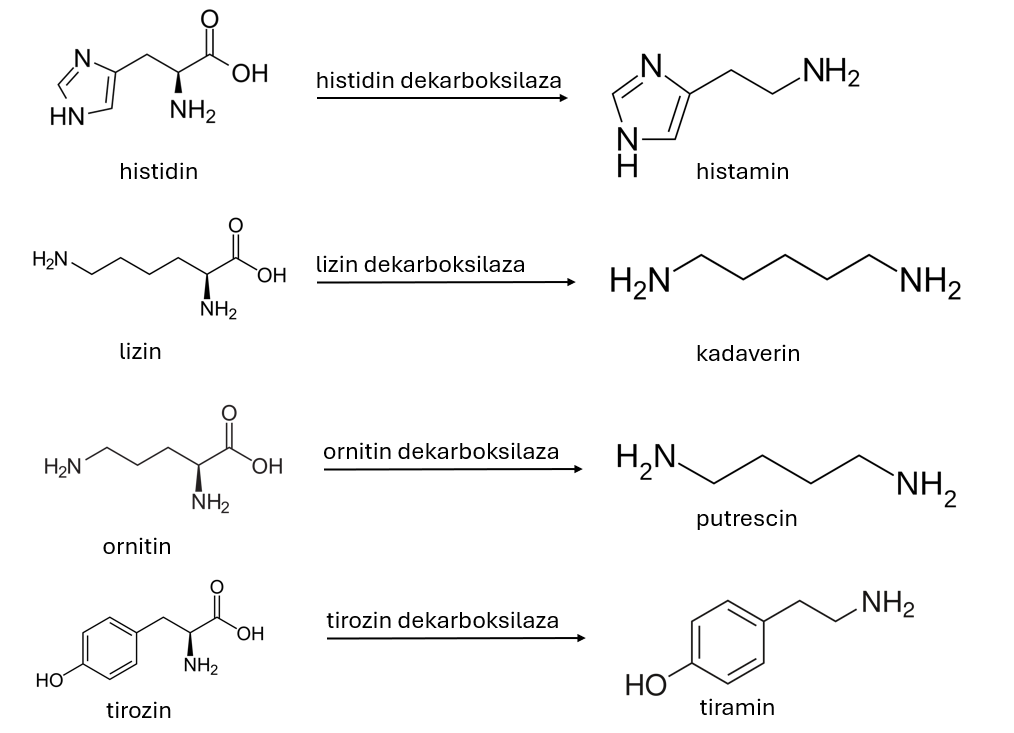
Za kvalitativno določanje aktivnosti aminokislinske dekarboksilaze 150 µL gojišča AADM brez agarja (tekoči medij) prenesemo v mikrotitrsko ploščo in inokuliramo s 50 µL predkulture mlečnokislinskih bakterij. Plošče inkubiramo 7 dni pri 28 °C brez stresanja. Pri sevih, ki tvorijo biogene amine, se barva gojišča spremeni v vijolično (Slika 3).
Kvantitativno določanje aktivnosti encimske dekarboksilaze in tvorbe biogenih aminov
Za kvantitativno določanje biogenih aminov, ki jih proizvajajo mlečnokislinske bakterije v mediju, 1,6 mL gojišča AADM (tekoče gojišče brez agarja) brez indikatorja pH nacepimo s 150 µL predkulture mlečnokislinskih bakterij v mikrotitrske plošče. Plošče inkubiramo 7 dni pri 28 °C.
Nato supernatant analiziramo z metodo TLC ali HPLC.
TLC – tankoplastna kromatografija
Metoda vključuje uporabo danzil klorida (0,5 % m/v v acetonu) kot derivatizacijsko sredstvo. Po tem protokolu k 200 µL vzorca dodamo 200 µL nasičenega natrijevega hidrogen karbonata (NaHCO3) in 400 µL raztopine dansil klorida. Reakcijsko zmes inkubiramo 1 uro pri 55 °C v termobloku v temi.
Po derivatizaciji vzorce pustimo nekaj minut pri sobni temperaturi. Nato dodamo 100 µL nasičenega NaCl in tej mešanici 200 µL izoheksana. Zmes stresamo 5 minut z namiznim stresalnikom (1000 vrt./min).
Na plošče s silikagelom 60 TLC brez fluorescentnega indikatorja nanesemo 20 µL organske faze derivatiziranega vzorca. Vzorce nanesemo na ploščo, 15 mm od spodnjega roba plošč, med alikvoti vzorcev naj bo razdalja 12 mm. TLC ploščo razvijemo v nasičeni stekleni komori. Uporabljeni topilo je zmes kloroforma in trietilamina v razmerju 4 : 1 (v/v). Skupna migracija je 17 cm. Razvoj plošče običajno traja 90 minut. Za vizualizacijo ločbe se TLC plošče osvetli s svetlobo valovne dolžine 312 nm. Primer rezultata takšne analize je na Sliki 3 (slika je bila zajeta s presevnikom GeneBox proizvajalca Syngene).
Eksperimentalni protokol
Materiali:
- TLC steklena komora
- TLC plošče (silikagel 60 brez fluorescentnega indikatorja)
- 20 µL mikrokapilare s kontrolnikom
- namizni stresalnik
- termoblok
- presevnik za zajem slike
- pipete
- analizna tehtnica
- orbitalni stresalnik
- erlenmajerice
- merilne bučke
- merilni valj
- centrifugirke (50 mL)
- mikroepruvete (1,5 mL, 0,5 mL)
- danzil klorid
- natrijev hidrogen karbonat (NaHCO3)
- natrijev klorid (NaCl)
- izoheksan
- aceton
- kloroform
- trimetilamin
- ddH2O
Za izvedbo eksperimenta pripravimo naslednje raztopine:
Priprava danzil klorida [0,5 % m/v v acetonu]: V 100 ml acetona odtehtamo 0,5 g danzil klorida in hranimo pri –20 °C.
Priprava nasičenega NaHCO3: Odtehtamo 9,6 g NaHCO3 v 100 ml ddH2O.
Priprava nasičenega NaCl: Odtehtamo 36 g NaCl v 100 ml ddH2O.
Priprava raztopine kloroforma in trietilamina v razmerju 4 : 1 (v/v): Prenesemo 80 mL kloroforma v 100-mL valj, ki ga nato dopolnimo do 100 mL s trietilaminom. Nastalo raztopino prenesemo v erlenmajerico in dobro premešamo. Raztopino vlijemo v TLC stekleno komoro – raztopine naj bo v višini 1 cm od dna posode (enakomerno, merjeno na ravni površini). V notranjost dodamo navaden filtrirni papir, da popolnoma nasičimo komoro s parami topila za razvijanje. Tako pustimo vsaj eno uro. Pred prenosom TLC plošče v komoro odstranimo filtrirni papir. TLC steklena komora z vloženo TLC ploščo je prikazana na Sliki 4.

Protokol derivatizacije vzorcev
- Prenesemo 200 µL vzorca v 1,5-mL mikroepruveto.
- Dodamo 200 µL nasičene raztopine NaHCO3.
- Dodamo 400 µL dansil klorida [0,5 % w/v v acetonu].
- Premešamo z orbitalnim stresalnikom.
- Inkubiramo 1 uro pri 55 °C v temi (pokrijemo z aluminijasto folijo).
- Pustimo pri sobni temperaturi 10 minut.
- Dodamo 100 µL nasičene raztopine NaCl.
- Dodamo 200 µL izoheksana.
- Stresamo 15 min z namiznim stresalnikom.
- Zberemo 20 µL organske faze (bistra tekočina na vrhu v mikroepruveti) z mikrokapilaro in tako prenesemo alikvot vzorca na TLC ploščo.
Protokol TLC
- Pripravimo TLC ploščo (20 x 20 cm). Uporabimo grafitni svinčnik! Vzorce nanesemo na črto, ki jo zarišemo 1,5 cm od začetka plošče (spodnjega roba). Z grafitnim svinčnikom označimo črto 1,5 cm na spodnjem in zgodnjem delu TLC plošče. Razdalja med vzorčnimi točkami mora biti najmanj 1,2 cm.
- Tako pripravljeno TLC ploščo postavimo v TLC komoro. Pri vstavljanju plošče moramo biti previdni, da se s ploščo ne dotaknemo sten komore in da je celotna plošča s spodnjim robom v tekočino vstavljena naenkrat (sicer eluent ne bo potoval enakomerno).
- Ko eluent doseže zgornjo označeno črto (1,5 cm od zgornjega roba prošče – torej je celotna migracija 17 cm od začetka poti eluenta), previdno odstranimo TLC ploščo iz komore in pustimo, da se plošča posuši (na zraku?).
- Ploščo dokumentiramo s presevnikom, tako da z enosekundno osvetlitvijo zajamemo pet slik. Uporabimo nastavitve kratkovalovne UV žarnice (primer dokumentirane plošče je prikazan na Sliki 5).

Metoda HPLC-DAD za določanje biogenih aminov
Protokol za določanje biogenih aminov, ki jih proizvajajo mlečnokislinske bakterije v medijih AADM, je bil pripravljen po že objavljenih protokolih (Mitar in sod., 2018, Manetta in sod., 2016) z nekaj prilagoditvami (Topić Božič in sod., 2022). Isti protokol se uporablja za določanje biogenih aminov v vinih.
Reagent danzil klorid (0,5 % m/v v acetonu) uporabimo kot derivatizacijsko sredstvo. K 250 µL vzorca (vino, fermentacijska mešanica ipd.) dodamo 70 µL nasičenega NaHCO3 in 65 µL 0,1-M kalijevega hidroksida (KOH). Tako pripravljen vzorec inkubiramo 45 minut pri 40 °C v termobloku v temi. Po inkubaciji mešanici dodamo 100 µL raztopine amonijaka (28–30 % v/v) in tako odstranimo odvečni danzil klorid (ki ni zreagiral). Nato vzorec dobro premešamo z orbitalnim stresalnikom (30 sekund) in nadalje inkubiramo (30 minut) pri sobni temperaturi v temi. Po drugi inkubaciji raztopini dodamo acetonitril do končnega volumna raztopine, ki je 5 mL. Pred analizo na HPLC-ju raztopino vzorca filtriramo skozi 0,22-µm filter PTFE. Za analizo tako pripravljenega vzorca uporabljamo kromatografski sistem HPLC z detektorjem na osnovi niza diod (DAD) ali UV-VIS detektorjem (254 nm) in gradientno elucijo mobilne faze A (voda) in mobilne faze B (acetonitril, čistoče HPLC). Ločbo izvajamo na reverznofazni kromatografski koloni (na primer Phenomenex Kinetex EVO C18 – 250 x 4,6 mm, 5 µm i.d.) z ujemajočo se predkolono. Kolono moramo med ločbo termostatirati na 25 °C.
Kvantificiranje izvajamo z zunanjimi standardi – s histaminom, putrescinom, kadaverinom in tiraminom. Volumen injiciranja je 20 µL. Pogoji gradientne elucije so naslednji (povzeti po Mitar in sod., 2018): 0–0,5 min 40 % B, 0,5–25 min 40–80 % B, 25–30 min 80–95 % B, 30–34 min 95 % B, 34–35 min 95–40 % B, 35–37 min 40 % B.
Eksperimentalni protokol
Materiali:
- termoblok
- pipete
- orbitalni stresalnik
- analizna tehtnica
- merilne bučke
- epruvete za centrifugiranje (50 mL)
- mikroepruvete (1,5 ml, 0,5 mL)
- viale HPLC (1,5 m)
- steklene viale (5 mL)
- plastične brizge za enkratno uporabo
- 0,22-µm filter PTFE
- standardi biogenih aminov: kadaverin, histamin, putrescin, tiramin
- dansil klorid
- natrijev hidrogen karbonat (NaHCO3)
- kalijev hidroksid (KOH)
- amonijak (28-30%)
- klorovodikova kislina (HCl (37%))
- acetonitril
- ddH2O
Priprava raztopin:
Priprava danzil klorida [0,5 % m/v v acetonu]: V 100 mL acetona odtehtamo 0,5 g danzil klorida. Hranimo pri –20 °C.
Priprava nasičenega NaHCO3: Odtehtamo 9,6 g NaHCO3 v 100 mL ddH2O.
Priprava 0,1 M KOH: Odtehtamo 0,561 g KOH v 100 mL ddH2O.
Priprava 0,1 M HCl: V 100-mL merilno bučko nalijemo malo vode. Dodamo 860 µL 37-% HCl in dopolnimo do oznake z ddH2O. Raztopino kisline v vodi je treba delati po vseh protokolih priprave kislin iz koncentrirane kisline in pod dimno napo.
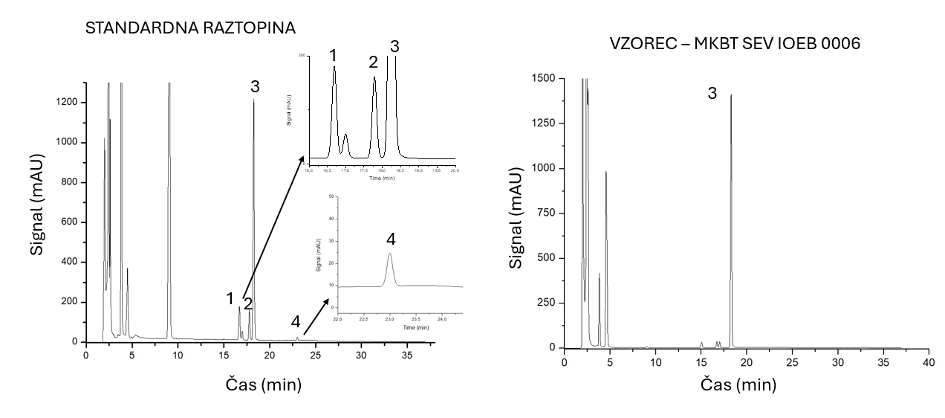
Priprava raztopin za umerjanje: Iz osnovne raztopine zmesi biogenih aminov s koncentracijo 1000 mg/L pripravimo raztopine za umerjanje v območju 1–100 mg/L (1 mg/L, 5 mg/L, 10 mg/L, 25 mg/L, 50 mg/L, 100 mg/L). Iz osnovnih raztopin posameznih biogenih aminov (1000 mg/L) pripravimo raztopine posameznih biogenih aminov s koncentracijo 100 mg/L (kadaverin 100 mg/L, histamin 100 mg/L, putrescin 100 mg/L, tiramin 100 mg/L). Za določanje retenzijskih časov bomo uporabili raztopine posameznih biogenih aminov. Na Sliki 5 je prikazan HPLC kromatogram standardne raztopine štirih biogenih aminov.
Protokol derivatizacije vzorcev
- Prenesemo 250 µL vzorca v 1,5-mL mikroepruveto.
- Dodamo 70 µL nasičene raztopine NaHCO3.
- Dodamo 65 µL 0,1-M KOH.
- Dodamo 1 mL danzil klorida [0,5 % m/v v acetonu].
- Premešamo z orbitalnim stresalnikom (30 sekund).
- Inkubiramo vzorec 45 min pri 40 °C v temi (pokrijemo z aluminijasto folijo).
- Dodamo 100 µL raztopine amonijaka (28–30 %).
- Premešamo z orbitalnim stresalnikom (30 sekund).
- Inkubiramo pri sobni temperaturi v temi za 30 min.
- Prenesemo v viale z večjim volumnom in dopolnimo do 5 mL z acetonitrilom.
- Tako pripravljen vzorec filtriramo skozi 0,22-µm filter PTFE v vialo HPLC.
- Alikvot vzorca injiciramo na HPLC ali shranimo pri –20 °C.
Na Sliki 6 sta predstavljena kromatograma standardne raztopine biogenih aminov in vzorca seva mlečnokislinskih bakterij, ki ima sposobnost tvorbe histamina. Iz podatkov kromatogramov standardnih raztopin pripravimo umeritvene krivulje, izračunamo enačbe premic in jih uporabimo za računanje koncentracij biogenih aminov v vzorcih vina ali fermentacijskih mešanic na podlagi površin vrhov v pripadajočih kromatogramih.
Viri
Barata, A., Malfeito-Ferreira, M., Loureiro, V. 2012. The microbial ecology of wine grape berries. Int. J. Food Microbiol.153, 243–259.
Battistelli, N., Perpetuini, G., Perla, C., Arfelli, G., Zulli, C., Rossetti, A. P., Tofalo, R. 2020. Characterization of natural Oenococcus oeni strains for Montepulciano d’Abruzzo organic wine production. Eur. Food Res. Technol. 246, 1031–1039. https://doi.org/10.1007/s00217-020-03466-3
Belda, I., Ruiz, J., Alastruey-Izquierdo, A., Navascués, E., Marquina, D., Santos, A. 2016. Unraveling the Enzymatic Basis of Wine "Flavorome": A Phylo-Functional Study of Wine Related Yeast Species. Front. Microbiol. 7, 12. https://doi.org/10.3389/fmicb.2016.00012
Coton, E., Coton, M. 2005. Multiplex PCR for colony direct detection of Gram-positive histamine- and tyramine-producing bacteria. J. Microbiol. Methods 63, 296–304. https://doi.org/10.1016/j.mimet.2005.04.001
Coton, M., Romano, A., Spano, G., Ziegler, K., Vetrana, C., Desmarais, C., Lonvaud-Funel, A., Lucas, P., Coton, E. 2010. Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider. Food Microbiol. 27, 1078–1085. https://doi.org/10.1016/j.fm.2010.07.012
del Rio, B., Fernandez, M., Redruello, B., Ladero, V., Alvarez, M. A. 2024. New insights into the toxicological effects of dietary biogenic amines. Food Chem. 435, 137558. https://doi.org/10.1016/j.foodchem.2023.137558
del Rio, B., Redruello, B., Linares, D. M., Ladero, V., Ruas-Madiedo, P., Fernandez, M., Martin, M. C., Alvarez, M. A. 2019. The biogenic amines putrescine and cadaverine show in vitro cytotoxicity at concentrations that can be found in foods. Sci. Rep. 9, 120. https://doi.org/10.1038/s41598-018-36239-w
Emer, C. d., Marques, S., Colla, L. m., Reinehr, C. o. 2021. Biogenic amines and the importance of starter cultures for malolactic fermentation. Aust. J. Grape Wine Res. 27, 26–33. https://doi.org/10.1111/ajgw.12462
Guo, Y. Y., Yang, Y. P., Peng, Q., Han, Y. 2015. Biogenic amines in wine: A review. Int. J. Food Sci. Technol. 50, 1523–1532. https://doi.org/10.1111/ijfs.12833
Henríquez-Aedo, K., Durán, D., Garcia, A., Hengst, M. B., Aranda, M. 2016. Identification of biogenic amines-producing lactic acid bacteria isolated from spontaneous malolactic fermentation of chilean red wines. LWT – Food Sci. Technol. 68, 183–189. https://doi.org/10.1016/j.lwt.2015.12.003
Kim, S., Chen, J., Cheng, T., Gindulyte, A., He, J., He, S., Li, Q., Shoemaker, B. A., Thiessen, P. A., Yu, B., Zaslavsky, L., Zhang, J., Bolton, E. E. 2023. PubChem 2023 update. Nucleic Acids Res. 51, D1373–D1380. https://doi.org/10.1093/nar/gkac956
Konakovsky, V., Focke, M., Hoffmann-Sommergruber, K., Schmid, R., Scheiner, O., Moser, P., Jarisch, R., Hemmer, W. 2011. Levels of histamine and other biogenic amines in high-quality red wines. Food Addit. Contam. – Part Chem.Anal. Control Expo. Risk Assess. 28, 408–416. https://doi.org/10.1080/19440049.2010.551421
Landete, J. M., Ferrer, S., Pardo,* I. 2004. Improved enzymatic method for the rapid determination of histamine in wine. Food Addit. Contam. 21, 1149–1154. https://doi.org/10.1080/02652030400019737
Landete, J. M., Rivas, B. D. L., Marcobal, A., Muñoz, R. 2011. PCR methods for the detection of biogenic amine-producing bacteria on wine. Ann. Microbiol. https://doi.org/10.1007/s13213-010-0068-6
Landete, J. M. J. Ä. M., Ferrer, S., Polo, L., Pardo, I. 2005. Biogenic amines in wines from three Spanish regions. J. Agric. Food Chem. 53, 1119–1124. https://doi.org/10.1021/jf049340k
Lange, J., Wittmann, C. 2002. Enzyme sensor array for the determination of biogenic amines in food samples. Anal. Bioanal. Chem. 372, 276–283. https://doi.org/10.1007/s00216-001-1130-9
Leonardo, S., Campàs, M. 2016. Electrochemical enzyme sensor arrays for the detection of the biogenic amines histamine, putrescine and cadaverine using magnetic beads as immobilisation supports. Microchim. Acta 183, 1881–1890. https://doi.org/10.1007/s00604-016-1821-8
Martínez-Pinilla, O., Guadalupe, Z., Hernández, Z., Ayestarán, B. 2013. Amino acids and biogenic amines in red varietal wines: The role of grape variety, malolactic fermentation and vintage. Eur. Food Res. Technol. 237, 887–895. https://doi.org/10.1007/s00217-013-2059-x
Martuscelli, M., Arfelli, G., Manetta, A. C., Suzzi, G. 2013. Biogenic amines content as a measure of the quality of wines of Abruzzo (Italy). Food Chem. 140, 590–597. https://doi.org/10.1016/j.foodchem.2013.01.008
Martuscelli, M., Mastrocola, D. 2019. Biogenic Amines: A Claim for Wines. V: Biogenic Amines. IntechOpen. https://doi.org/10.5772/intechopen.80362
Mir-Cerdà, A., Izquierdo-Llopart, A., Saurina, J., Sentellas, S. 2021. Oenological processes and product qualities in the elaboration of sparkling wines determine the biogenic amine content. Fermentation 7. https://doi.org/10.3390/fermentation7030144
Mitar, I., Ljubenkov, I., Rohtek, N., Prkíc, A., Andelíc, I., Vuletíc, N. 2018. The content of biogenic amines in croatian wines of different geographical origins. Molecules 23. https://doi.org/10.3390/molecules23102570
Moreira, L., Milheiro, J., Filipe-Ribeiro, L., Cosme, F., Nunes, F. M. 2024. Exploring factors influencing the levels of biogenic amines in wine and microbiological strategies for controlling their occurrence in winemaking. Food Res. Int.190, 114558. https://doi.org/10.1016/j.foodres.2024.114558
Moreno-Arribas, M. V., Polo, M. C. 2008. Occurrence of lactic acid bacteria and biogenic amines in biologically aged wines. https://doi.org/10.1016/j.fm.2008.05.004
Moreno-Arribas, M. V., Polo, M. C., Jorganes, F., Muñoz, R. 2003. Screening of biogenic amine production by lactic acid bacteria isolated from grape must and wine. Int. J. Food Microbiol. 84, 117–123. https://doi.org/10.1016/S0168-1605(02)00391-4
Nannelli, F., Claisse, O., Gindreau, E., Revel, G. D., Lonvaud-Funel, A., Lucas, P. M. 2008. Determination of lactic acid bacteria producing biogenic amines in wine by quantitative PCR methods. Lett. Appl. Microbiol. 47, 594–599. https://doi.org/10.1111/j.1472-765X.2008.02472.x
Neofotistos, A.-D. G., Tsagkaris, A. S., Danezis, G. P., Proestos, C. 2019. Emerging Trends in Biogenic Amines Analysis. V: Biogenic Amines. IntechOpen. https://doi.org/10.5772/intechopen.81274
Papageorgiou, M., Lambropoulou, D., Morrison, C., Kłodzińska, E., Namieśnik, J., Płotka-Wasylka, J. 2018. Literature update of analytical methods for biogenic amines determination in food and beverages. TrAC – Trends Anal. Chem. 98, 128–142. https://doi.org/10.1016/j.trac.2017.11.001
Perestrelo, R., Bordiga, M., Locatelli, M., Silva, C., Câmara, J. S. 2020. Polyphenols, biogenic amines and amino acids patterns in Verdelho wines according to vintage. Microchem. J. 153, 104383. https://doi.org/10.1016/j.microc.2019.104383
Prete, V. D., Costantini, A., Cecchini, F., Morassut, M., Garcia-Moruno, E. 2009. Occurrence of biogenic amines in wine: The role of grapes. Food Chem. 112, 474–481. https://doi.org/10.1016/j.foodchem.2008.05.102
Restuccia, D., Sicari, V., Pellicanò, T. M., Spizzirri, U. G., Loizzo, M. R., 2017. The impact of cultivar on polyphenol and biogenic amine profiles in Calabrian red grapes during winemaking. Food Res. Int. 102, 303–312. https://doi.org/10.1016/j.foodres.2017.10.012
Rivas, B. D. L., Marcobal, Á., Muñoz, R. 2005. Improved multiplex-PCR method for the simultaneous detection of food bacteria producing biogenic amines. FEMS Microbiol. Lett. 244, 367–372. https://doi.org/10.1016/j.femsle.2005.02.012
Roškar, N., Roškar, Z. 2020. Skombroidni sindrom − prikaz kliničnih primerov. Slov. Pediatr. Rev. Pediatrov Slov. Spec. Šol. ter Visok. Med. Slov. 27, 133–136. https://doi.org/10.38031/slovpediatr-2020-3-05
Sebastian, P., Herr, P., Fischer, U., König, H. 2011. Molecular Identification of Lactic Acid Bacteria Occurring in Must and Wine. South Afr. J. Enol. Vitic. 32, 300–309. https://doi.org/10.21548/32-2-1390
Soufleros, E., Barrios, M. L., Bertrand, A. 1998. Correlation between the content of biogenic amines and other wine compounds. Am. J. Enol. Vitic. 49, 266–278.
Stratta, P., Badino, G. 2012. Scombroid poisoning. Cmaj 184, 674–674.
Tofalo, R., Perpetuini, G., Schirone, M., Suzzi, G., in sod. 2016. Biogenic amines: Toxicology and health effect. Encycl. Food Health 1, 424–429.
Topić Božič, J., Butinar, L., Bergant Marušič, M., Korte, D., Mozetič Vodopivec, B. 2022. Determination of biogenic amines formation by autochthonous lactic acid bacteria from ‘Refošk’ grapes using different analytical methods. LWT156, 112908. https://doi.org/10.1016/j.lwt.2021.112908
Vanda, P., Miranda, A., Leca, J. M., Marques, J. C. 2017. Analytical methodologies for the determination of biogenic amines in wines: an overview of the recent trends. J. Anal. Bioanal. Sep. Tech. 2, 52–57. https://doi.org/10.15436/2476-1869.17.1296
Vinci, G., Maddaloni, L., Prencipe, S. A., Ruggieri, R. 2021. Natural Contaminants in Wines: Determination of Biogenic Amines by Chromatographic Techniques. Int. J. Environ. Res. Public. Health 18, 10159. https://doi.org/10.3390/ijerph181910159
Žurga, P., Vahčić, N., Pasković, I., Banović, M., Staver, M. M. 2019. Occurence of ochratoxin A and biogenic amines in Croatian commercial red wines. Foods 8. https://doi.org/10.3390/foods8080348
